Longtemps oubliée de la recherche, la paralysie supranucléaire progressive (PSP) connaît en 2024-2025 un tournant historique. Entre financement record, essais cliniques innovants et nouveaux médicaments prometteurs, cette maladie rare pourrait enfin sortir de l’impasse thérapeutique. Décryptage d’une révolution en marche.
En tant que médecin, j’ai utilisé l’intelligence artificielle pour m’aider à rassembler et organiser les données. Ces nouveaux outils rendent enfin possible ce type d’article de synthèse sur des pathologies complexes, tout en laissant au médecin la responsabilité de vérifier, nuancer et valider chaque information. Le niveau technique de c et article est assez élevé, mais il intéressera les familles concernées, et les médecins.
Article rédigé par le Dr Michel Bensadoun,
L’auteur ne déclare aucun conflit d’intérêts concernant cet article.
La paralysie supranucléaire progressive fait partie de ces maladies dont personne ne parle, mais qui bouleversent la vie de dizaines de milliers de familles. Environ 30 000 Américains en sont atteints, un chiffre comparable à la sclérose latérale amyotrophique (SLA), pourtant bien plus médiatisée. Pendant des décennies, les patients PSP et leurs proches ont entendu la même rengaine : « Il n’y a pas de traitement, désolé. » Mais 2024 et 2025 pourraient bien marquer un tournant historique.
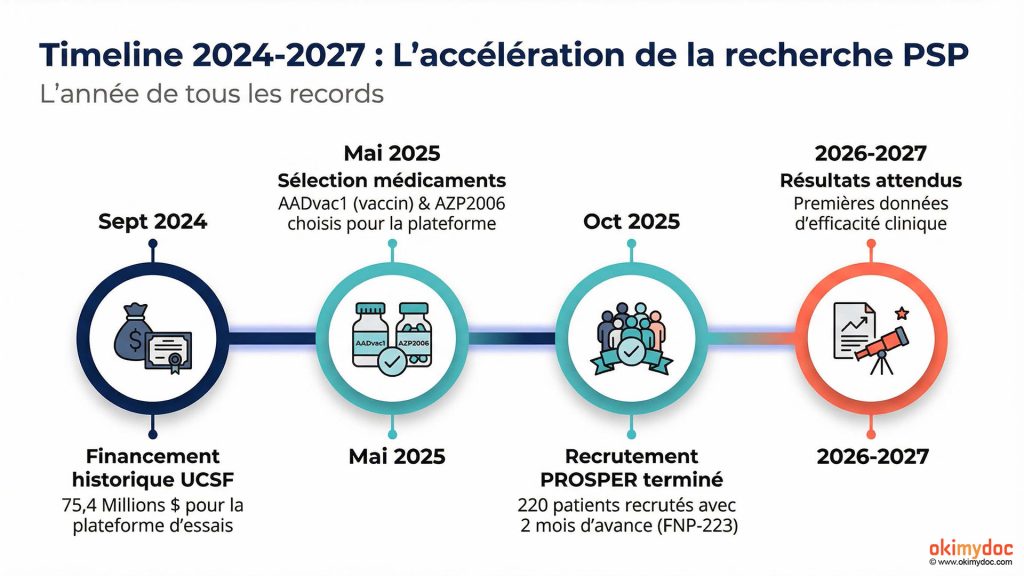
En septembre 2024, l’Université de Californie à San Francisco (UCSF) a annoncé un financement de 75,4 millions de dollars pour lancer une plateforme d’essais cliniques révolutionnaire. En mai 2025, deux médicaments anti-tau ont été sélectionnés pour les premiers tests. En octobre 2025, un troisième candidat médicament a terminé son recrutement avec deux mois d’avance. Pour une maladie orpheline comme la PSP, c’est du jamais vu.
Alors, sommes-nous vraiment à l’aube d’une révolution thérapeutique ? Quels sont ces nouveaux traitements qui suscitent tant d’espoir ? Et surtout, qu’est-ce que cela change concrètement pour les patients ? Plongée dans l’actualité scientifique d’une maladie qui sort enfin de l’ombre.
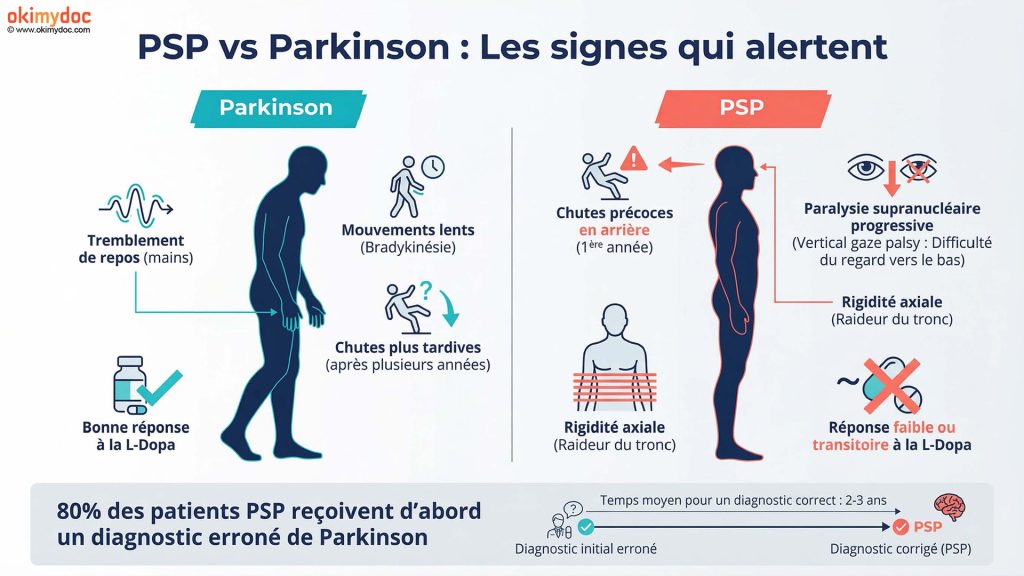
PSP : La maladie qu’on confond avec Parkinson
Qu’est-ce que la paralysie supranucléaire progressive ?
La PSP est une maladie neurodégénérative rare qui touche principalement les personnes entre 50 et 70 ans. Son nom compliqué cache une réalité clinique brutale : une dégénérescence progressive de certaines zones du cerveau qui contrôlent les mouvements, l’équilibre et les fonctions cognitives. En moyenne, la survie se situe autour de 6 à 7 ans après le début des symptômes, avec des variations importantes d’un patient à l’autre (certains vivent plus de 10 ans, d’autres déclinent en 3 à 4 ans).
En deux phrases : La PSP provoque une accumulation anormale de protéine tau dans le cerveau, entraînant la mort progressive des neurones. Contrairement à Parkinson où les traitements peuvent améliorer les symptômes pendant des années, la PSP progresse rapidement et ne répond pratiquement pas aux médicaments antiparkinsoniens.
La forme la plus fréquente, appelée syndrome de Richardson, représente environ 60 à 70% des cas. Elle se caractérise par quatre symptômes cardinaux qui la distinguent de Parkinson : une paralysie du regard vertical (difficulté à regarder vers le bas), des chutes en arrière fréquentes dès la première année, une rigidité du tronc plus marquée que celle des membres, et une résistance quasi-totale à la lévodopa, le traitement de référence de Parkinson.
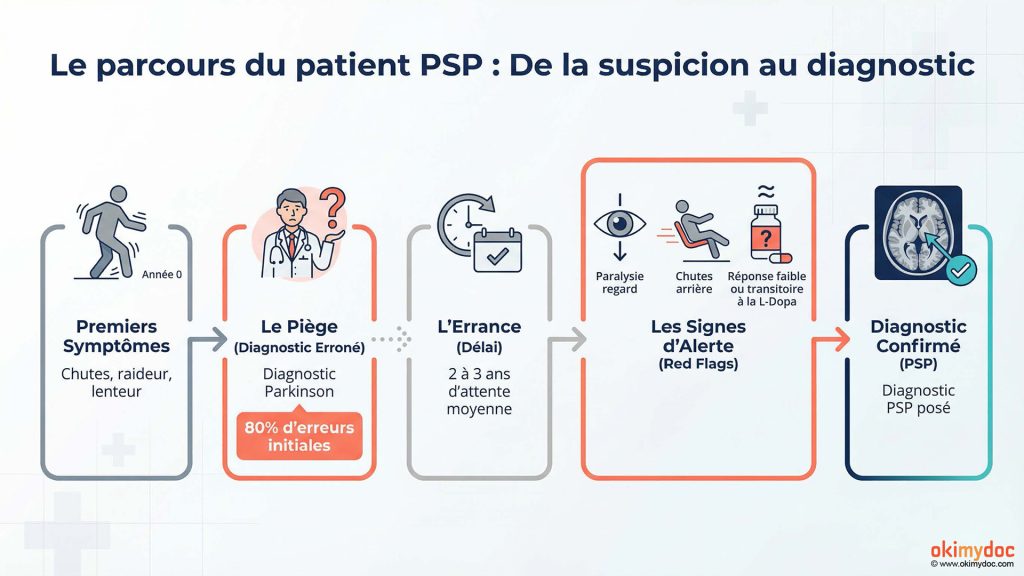
Le diagnostic et l’évolution
Le diagnostic de PSP reste un défi médical. En moyenne, il faut deux à trois ans entre les premiers symptômes et le diagnostic définitif, et près de 80% des patients reçoivent d’abord un diagnostic erroné de maladie de Parkinson. Plusieurs signes doivent alerter : chutes très précoces (dès la première année), paralysie du regard vertical qui complique la lecture et la descente d’escaliers, et absence totale de réponse à la lévodopa.
Le diagnostic repose sur l’examen clinique et l’IRM cérébrale, qui peut montrer une atrophie caractéristique du mésencéphale donnant le signe du « colibri » ou du « pingouin » sur les coupes sagittales. Contrairement à Alzheimer où les biomarqueurs sanguins émergent rapidement, il n’existe pas encore de test sanguin fiable pour la PSP, même si la recherche avance dans ce domaine.
La progression suit généralement un schéma inexorable : troubles moteurs croissants, chutes fréquentes, troubles de la déglutition augmentant le risque de pneumonies d’inhalation (principale cause de décès), dépendance progressive, troubles cognitifs touchant l’attention et la planification (mais pas la mémoire comme dans Alzheimer).
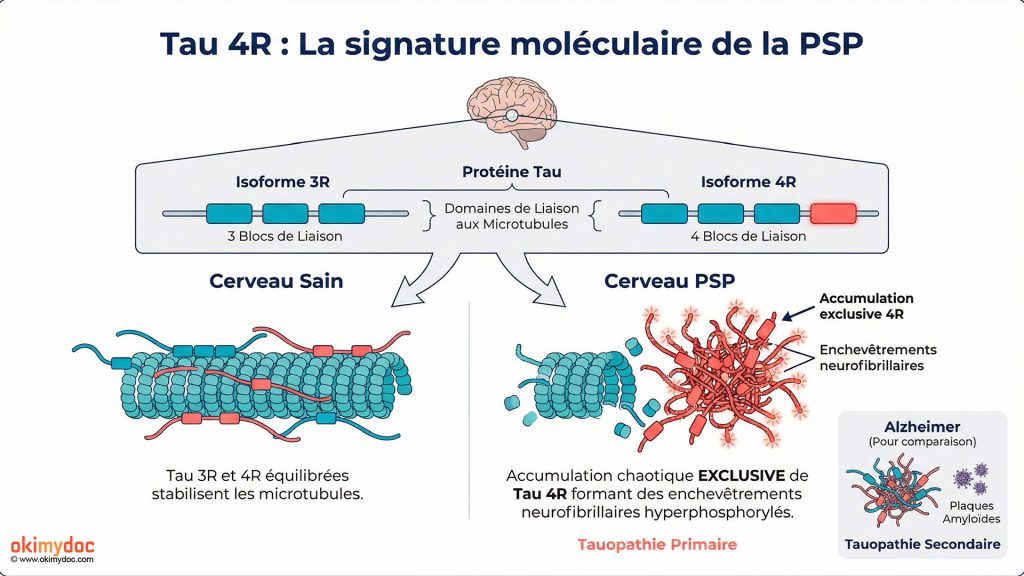
La protéine tau : Le coupable identifié
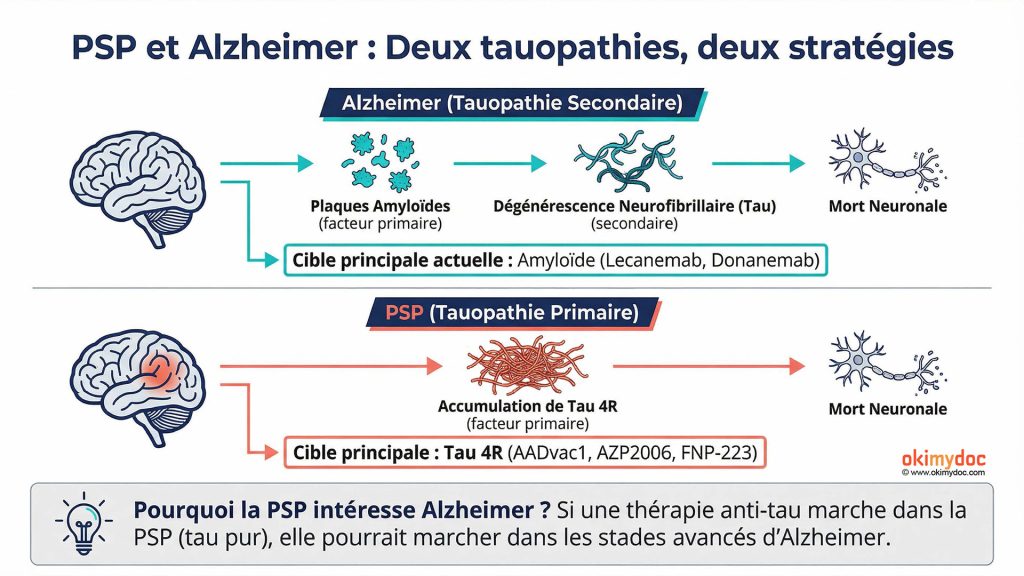
PSP et Alzheimer : Deux tauopathies, deux histoires
La PSP appartient à la famille des tauopathies, des maladies caractérisées par l’accumulation anormale de protéine tau dans le cerveau. Mais contrairement à la maladie d’Alzheimer, où tau intervient secondairement après l’accumulation de plaques amyloïdes, la PSP est une tauopathie primaire. Autrement dit, tau est LE problème principal dès le début, pas un dommage collatéral.
Cette distinction est cruciale pour comprendre les stratégies thérapeutiques. Dans Alzheimer, cibler l’amyloïde en premier a donné des résultats modestes avec le lecanemab et le donanemab, mais ces traitements ne fonctionnent qu’aux stades très précoces. Dans la PSP, pas d’amyloïde à éliminer : tau est la cible directe et évidente. C’est d’ailleurs pour cette raison que la PSP intéresse tant les chercheurs travaillant sur Alzheimer. Si une thérapie anti-tau fonctionne dans la PSP, elle pourrait également être efficace dans les stades avancés d’Alzheimer où tau joue un rôle majeur.
Pour aller plus loin : Notre article sur Alzheimer 2026 : Où en est la recherche ? détaille les avancées récentes sur les thérapies anti-tau et leur potentiel dans différentes maladies neurodégénératives. Pour une vue détaillée des traitements ciblant tau dans Alzheimer (dont certains pourraient un jour concerner la PSP), ce lien vous donnera toutes les clés de compréhension.
Tau 4R : La signature moléculaire de la PSP
La protéine tau existe sous plusieurs formes, ou isoformes, selon le nombre de domaines de liaison aux microtubules. Dans un cerveau sain, on trouve un équilibre entre tau 3R (trois domaines) et tau 4R (quatre domaines). Dans la PSP, c’est presque exclusivement la forme 4R qui s’accumule de manière anormale et hyperphosphorylée.
Cette spécificité moléculaire a des implications thérapeutiques importantes. Les traitements qui ciblent spécifiquement tau 4R pourraient être particulièrement efficaces dans la PSP, tout en épargnant les formes physiologiques de tau nécessaires au bon fonctionnement neuronal. C’est d’ailleurs l’une des pistes explorées par plusieurs laboratoires pharmaceutiques.
L’accumulation de tau 4R dans la PSP suit une distribution anatomique caractéristique, touchant préférentiellement le mésencéphale, les noyaux gris centraux et le cortex frontal. Cette topographie explique la combinaison unique de symptômes moteurs et cognitifs observée dans la maladie.
2024-2025 : L’année de tous les records
75 millions de dollars : Un financement historique
En septembre 2024, l’annonce est tombée comme un coup de tonnerre dans le petit monde de la recherche sur la PSP. Le National Institute on Aging (NIA), l’agence américaine de référence pour la recherche sur le vieillissement, a accordé un financement de 75,4 millions de dollars sur cinq ans à l’UCSF pour lancer une plateforme d’essais cliniques dédiée à la PSP.
Pour mettre ce chiffre en perspective, il s’agit de l’un des plus importants financements jamais accordés par l’UCSF pour une maladie neurodégénérative. À titre de comparaison, le budget annuel total de CurePSP, la principale association de patients dédiée à cette maladie, tourne autour de 5 millions de dollars. Ce financement représente donc quinze fois le budget annuel de l’association de référence.
Mais au-delà du montant, c’est surtout le design innovant de cette plateforme qui suscite l’enthousiasme. Menée par le Dr Julio Rojas et le Dr Adam Boxer de l’UCSF, en collaboration avec le Dr Irene Litvan de UC San Diego et le Dr Anne-Marie Wills du Massachusetts General Hospital, cette plateforme s’inspire du modèle utilisé avec succès dans la SLA.
Selon le Dr Julio Rojas : « L’espoir est que cette étude transforme le type de soins que reçoivent les patients PSP. Si aucun des trois premiers médicaments n’est efficace, nous continuerons avec d’autres. Même si nous ralentissons la progression de la maladie de 20 à 30%, c’est un impact significatif sur une condition à progression implacable et sans traitement. »
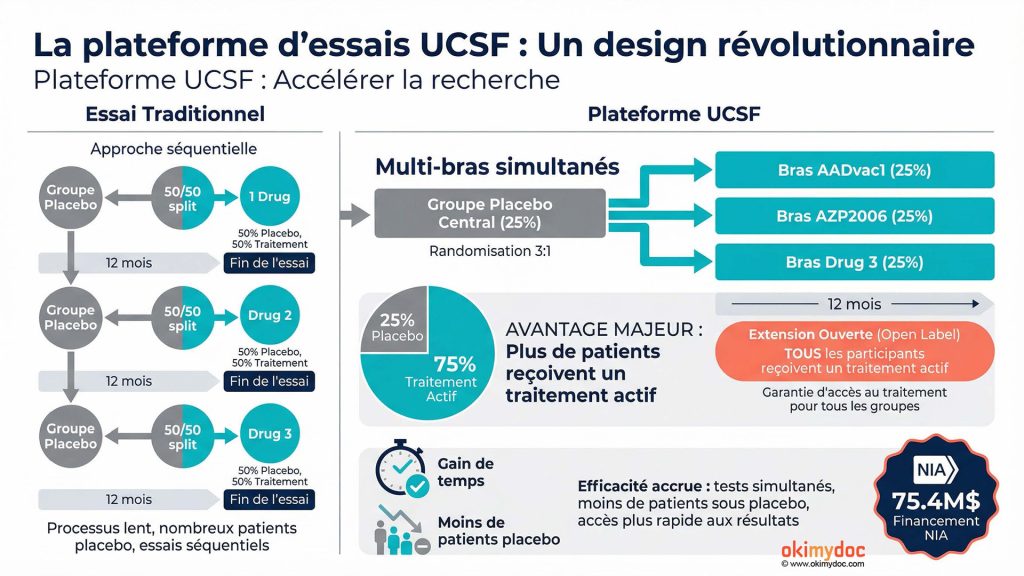
Le design révolutionnaire de la plateforme
Contrairement aux essais cliniques traditionnels où chaque médicament est testé séparément dans une étude dédiée, la plateforme PSP permet de tester plusieurs médicaments simultanément et successivement contre le même groupe contrôle. Cette approche présente plusieurs avantages majeurs qui changent la donne pour les patients et la recherche.
Premier avantage : Moins de patients sous placebo. Dans un essai classique, 50% des participants reçoivent un placebo. Dans la plateforme PSP, cette proportion tombe à 25%, ce qui signifie que 75% des participants ont une chance de recevoir un traitement actif. Pour une maladie aussi agressive que la PSP, où chaque mois compte, c’est une différence cruciale.
Deuxième avantage : Accès garanti à un traitement actif. Après un an de participation, tous les patients, y compris ceux qui étaient sous placebo, auront l’opportunité de recevoir un médicament actif dans le cadre d’une extension ouverte. Fini le sentiment d’avoir « perdu » un an sous placebo sans aucun bénéfice.
Troisième avantage : Rapidité et efficacité. Si un médicament se révèle inefficace, il est rapidement écarté et remplacé par un nouveau candidat, sans avoir à recruter une nouvelle cohorte de patients. Cette approche adaptative permet de tester beaucoup plus de molécules en beaucoup moins de temps.
Quatrième avantage : Partage des données. Toutes les données, images cérébrales et bioéchantillons collectés dans le cadre de la plateforme seront partagés avec les chercheurs du monde entier. Cette approche collaborative accélère la recherche bien au-delà des seuls médicaments testés dans la plateforme.
Le recrutement devrait démarrer fin 2025, avec jusqu’à 50 sites participants aux États-Unis. L’accent sera mis sur la diversité des participants, avec un effort particulier pour inclure des populations hispanophones et afro-américaines, traditionnellement sous-représentées dans les essais cliniques. Des mesures concrètes seront mises en place : évaluations en espagnol, prise en charge des frais de transport et d’hébergement, cliniciens parlant la langue des participants.
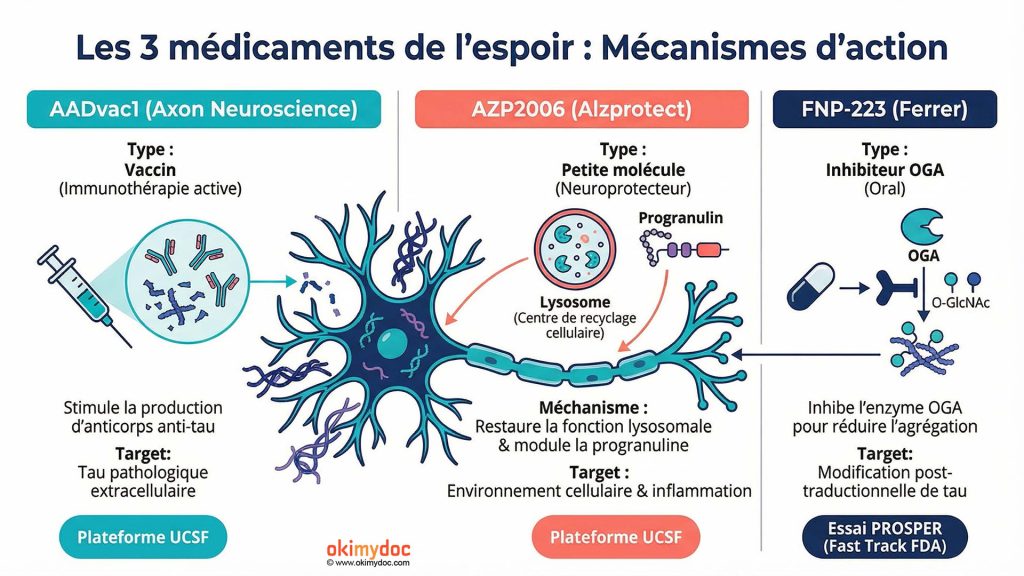
Les trois médicaments de l’espoir
AADvac1 : Le vaccin anti-tau
Le premier médicament sélectionné pour la plateforme PSP est AADvac1, développé par la société slovaque Axon Neuroscience. Il s’agit d’une immunothérapie active, autrement dit un vaccin qui stimule le système immunitaire du patient pour qu’il produise ses propres anticorps contre la protéine tau pathologique.
Le principe : AADvac1 cible spécifiquement les formes anormales de tau associées à la PSP, déclenchant la production d’anticorps qui se lient à ces protéines toxiques et empêchent leur propagation d’une cellule à l’autre. Contrairement aux anticorps monoclonaux administrés par perfusion (comme le lecanemab dans Alzheimer), cette approche vaccinale stimule une réponse immunitaire endogène, potentiellement plus durable.
Les résultats préliminaires : AADvac1 a déjà été testé dans des essais de Phase 1 et 2 dans la maladie d’Alzheimer, montrant un profil de sécurité acceptable et une capacité à induire une réponse immunitaire chez la majorité des patients. Des études précliniques dans des modèles animaux de tauopathies ont démontré une réduction de l’accumulation de tau et une amélioration des déficits cognitifs.
L’avantage théorique : Si le vaccin fonctionne, les patients pourraient bénéficier d’une protection prolongée avec des injections espacées (tous les trois à six mois), plutôt que des perfusions mensuelles coûteuses. De plus, le coût de production d’un vaccin est généralement bien inférieur à celui d’anticorps monoclonaux, ce qui pourrait faciliter l’accès au traitement.
Le défi : L’immunothérapie active a connu des échecs retentissants par le passé, notamment avec l’AN1792 dans Alzheimer, qui avait provoqué des méningoencéphalites chez certains patients. AADvac1 a été conçu pour éviter ces écueils en ciblant spécifiquement les formes pathologiques de tau, mais la preuve d’efficacité clinique reste à faire.
AZP2006 : L’approche indirecte
Le deuxième médicament sélectionné, AZP2006 développé par la société française Alzprotect, adopte une stratégie radicalement différente. Plutôt que de cibler directement tau, il s’attaque à l’environnement cellulaire qui favorise son accumulation.
Le mécanisme d’action : AZP2006 agit sur deux fronts complémentaires. D’une part, il restaure la fonction des lysosomes, ces organelles cellulaires qui servent de « stations d’épuration » pour dégrader les protéines endommagées. Dans la PSP, les lysosomes fonctionnent mal, permettant à tau de s’accumuler. D’autre part, AZP2006 module la production de progranuline, une protéine neuroprotectrice qui réduit l’agrégation de tau et la neuroinflammation.
En deux phrases : Plutôt que d’attaquer directement tau, AZP2006 aide les cellules à mieux éliminer leurs déchets protéiques et réduit l’inflammation qui aggrave la maladie. C’est comme améliorer le système de nettoyage d’une ville plutôt que de ramasser les ordures une par une.
Les données précliniques : Dans des modèles animaux de tauopathies, AZP2006 a montré une capacité à réduire l’accumulation de tau, diminuer la neuroinflammation et améliorer les performances cognitives. Des études de Phase 1 chez l’humain ont confirmé un bon profil de sécurité et une bonne tolérance.
L’intérêt de cette approche : En ciblant les mécanismes cellulaires plutôt que tau directement, AZP2006 pourrait avoir des effets bénéfiques plus larges, protégeant les neurones de multiples agressions. De plus, cette approche pourrait être efficace même si tau n’est pas le seul problème dans la PSP, une hypothèse de plus en plus discutée par les chercheurs.
FNP-223 : Le champion de la rapidité
Parallèlement à la plateforme UCSF, un troisième médicament prometteur avance à grands pas. FNP-223, développé par le laboratoire espagnol Ferrer, a terminé le recrutement de son essai de Phase 2 avec deux mois d’avance sur le calendrier, un exploit rare dans le monde des essais cliniques.
Le recrutement record : Entre août 2024 et octobre 2025, l’essai PROSPER a recruté 220 patients PSP dans 44 centres répartis en Europe, au Royaume-Uni et aux États-Unis. Terminer un recrutement avec deux mois d’avance témoigne de l’engagement exceptionnel des équipes et de l’intérêt des patients pour ce nouveau traitement.
Le mécanisme : FNP-223 est un inhibiteur oral de l’enzyme OGA (O-GlcNAcase). Cette enzyme enlève des groupes O-GlcNAc des protéines, un processus qui entre en compétition avec la phosphorylation. En inhibant OGA, on favorise l’O-GlcNAcylation de tau, ce qui empêche sa phosphorylation excessive et donc son agrégation. C’est une approche élégante qui vise à rééquilibrer les modifications post-traductionnelles de tau.
L’avantage majeur : FNP-223 est administré par voie orale, un avantage considérable par rapport aux perfusions intraveineuses. Pour les patients PSP qui ont déjà des difficultés de mobilité, pouvoir prendre un comprimé à domicile plutôt que de se rendre mensuellement à l’hôpital pour une perfusion change radicalement la qualité de vie.
La désignation Fast Track : En juin 2025, la FDA américaine a accordé à FNP-223 la désignation Fast Track, un statut réservé aux médicaments destinés à traiter des maladies graves pour lesquelles il existe un besoin médical non satisfait. Cette désignation facilite les échanges avec la FDA et peut accélérer le processus d’approbation si les résultats sont positifs.
Le calendrier : L’essai PROSPER suit les patients pendant 52 semaines de traitement, suivi de 4 semaines d’observation. Si tout se déroule comme prévu, les résultats principaux pourraient être connus entre 2026 et 2027. Si les données sont positives, FNP-223 pourrait devenir le premier traitement approuvé pour la PSP, une perspective qui galvanise toute la communauté.
Au-delà des trois mousquetaires
GV-1001 : L’approche anti-inflammatoire
D’autres candidats médicaments sont dans les starting-blocks. GV-1001, une injection sous-cutanée, devrait démarrer un essai clinique fin 2025 ou début 2026. Ce peptide dérivé de la télomérase (hTERT) pénètre dans les cellules en se liant à des protéines de choc thermique (HSP90/70) et exerce des effets anti-inflammatoires et neuroprotecteurs en modulant différentes voies de signalisation intracellulaire, notamment NF-κB et certaines cytokines pro-inflammatoires.
En deux phrases : GV-1001 n’agit pas directement sur tau, mais réduit l’inflammation cérébrale chronique qui aggrave la maladie. En modulant les voies inflammatoires, il pourrait ralentir la dégénérescence même sans éliminer complètement tau.
Cette approche part du principe que la neuroinflammation joue un rôle majeur dans la progression de la PSP. Des observations suggèrent que la neuroinflammation est un prédicteur important de la progression de la maladie, au même titre que la charge en tau, et que les deux phénomènes sont étroitement intriqués. La neuroinflammation chronique, caractérisée par l’activation excessive des cellules microgliales et la production de cytokines pro-inflammatoires, crée un environnement toxique pour les neurones.
Autres candidats prometteurs
Le paysage thérapeutique de la PSP s’enrichit rapidement. Parmi les autres candidats à surveiller :
AMX0035 (ORION) : Cette combinaison de taurursodiol et phénylbutyrate fait actuellement l’objet d’un essai de phase 2b/3 mondial dans la PSP, avec des résultats attendus autour de 2026. Cette approche vise à protéger les mitochondries et à réduire le stress du réticulum endoplasmique, deux mécanismes impliqués dans la mort neuronale.
Anticorps anti-tau : Plusieurs programmes d’anticorps monoclonaux ciblant tau sont encore en développement, même si certains ont été arrêtés dans les tauopathies primaires. Les leçons tirées des échecs permettent d’affiner les approches futures.
Les biomarqueurs : La révolution silencieuse
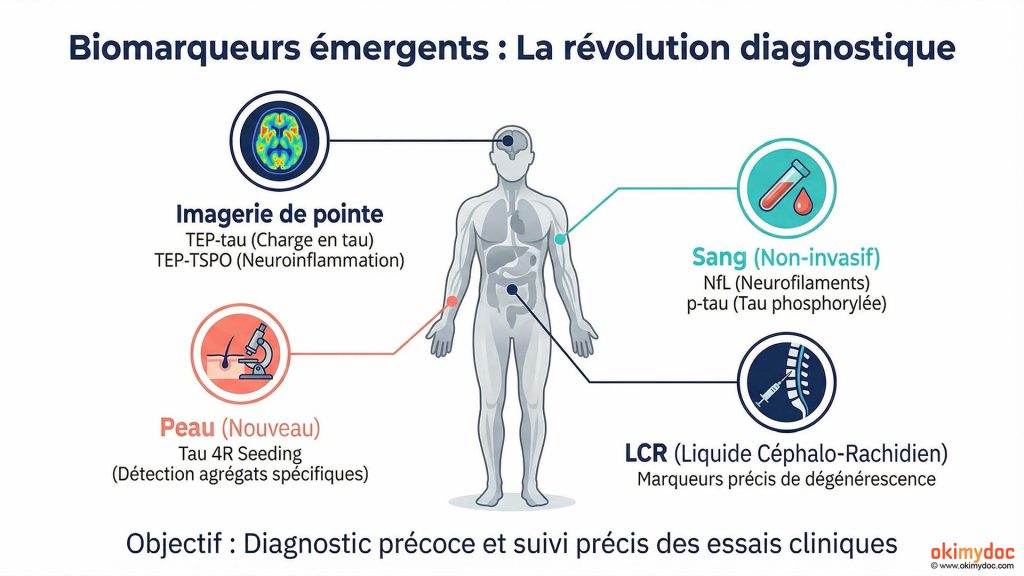
Parallèlement au développement de nouveaux traitements, la recherche sur les biomarqueurs progresse rapidement. Plusieurs équipes travaillent sur des tests sanguins capables de détecter la PSP précocement et de suivre sa progression. L’identification de biomarqueurs fiables révolutionnerait le diagnostic, actuellement basé uniquement sur l’examen clinique et l’imagerie.
Une étude récente a identifié des formes spécifiques de tau 4R dans la peau de patients PSP, ouvrant la voie à un diagnostic par simple biopsie cutanée. D’autres travaux explorent les neurofilaments à chaîne légère (NfL) dans le sang, des marqueurs de dégénérescence neuronale qui augmentent dans la PSP et pourraient servir à monitorer l’efficacité des traitements.
Les tests de « tau seeding » 4R (seeding assays) représentent une autre avancée prometteuse. Ces tests détectent la capacité des agrégats de tau à propager leur conformation anormale, permettant de mieux distinguer les tauopathies 4R comme la PSP. Bien qu’encore en phase de recherche, ces outils pourraient transformer le diagnostic dans les années à venir.
Ces biomarqueurs sont cruciaux pour les essais cliniques. Ils permettent de confirmer le diagnostic avec certitude, d’exclure les patients mal diagnostiqués qui dilueraient les résultats, et de mesurer objectivement l’effet des traitements sur la pathologie sous-jacente, pas seulement sur les symptômes.
L’imagerie de pointe : Voir tau en direct
L’imagerie par TEP-scan avec des traceurs spécifiques de tau progresse également. Ces techniques permettent de visualiser et quantifier l’accumulation de tau dans le cerveau vivant, offrant une fenêtre unique sur la progression de la maladie. Plusieurs essais cliniques utilisent désormais la TEP-tau comme critère d’évaluation secondaire, permettant de vérifier si les traitements réduisent effectivement la charge en tau.
La TEP-TSPO, qui visualise l’activation microgliale (marqueur de neuroinflammation), apporte également des informations précieuses. Des études ont montré que l’intensité de l’inflammation détectée par TEP-TSPO prédit la vitesse de progression clinique, validant l’importance de cibler la neuroinflammation.
L’IRM de diffusion et les techniques d’imagerie fonctionnelle apportent également des informations sur la connectivité cérébrale et l’activité neuronale. Ces outils permettent de détecter des changements subtils bien avant que les symptômes ne s’aggravent, ouvrant la possibilité d’interventions plus précoces.
Ce qui change concrètement pour les patients
L’accès aux essais cliniques : Une fenêtre d’opportunité
Pour les patients PSP et leurs familles, ces avancées se traduisent d’abord par un accès sans précédent aux essais cliniques. Avec la plateforme UCSF qui recrutera dans 50 sites, l’essai PROSPER qui s’étend sur trois continents, et d’autres essais en préparation, les opportunités de participer à la recherche n’ont jamais été aussi nombreuses.
Participer à un essai clinique présente plusieurs avantages concrets. D’abord, une chance de bénéficier d’un traitement potentiellement efficace avant son approbation. Ensuite, un suivi médical rapproché et spécialisé, avec des examens réguliers par des experts de la PSP. Enfin, la satisfaction de contribuer à faire avancer la recherche pour les générations futures.
Pour s’informer sur les essais en cours : Le site de CurePSP (www.psp.org) maintient une liste actualisée des essais cliniques recrutant des patients. Le registre FTD Disorders permet également de rester informé des nouvelles opportunités de participation.
Les critères d’éligibilité : Qui peut participer ?
La plupart des essais actuels ciblent les patients avec un syndrome de Richardson, la forme la plus fréquente de PSP, diagnostiqués depuis moins de cinq ans. Cette restriction s’explique par la volonté de tester les traitements aux stades où ils ont le plus de chances d’être efficaces, avant que les dégâts neuronaux ne soient trop importants.
Les patients doivent généralement être accompagnés d’un aidant qui pourra assister aux visites et fournir des informations sur l’évolution des symptômes. Des examens préalables sont nécessaires pour confirmer le diagnostic et exclure d’autres pathologies. La mobilité doit être suffisante pour se rendre aux visites de suivi, bien que des aides financières pour le transport et l’hébergement soient souvent proposées.
Ce qui aide déjà aujourd’hui
En attendant les résultats des essais cliniques, plusieurs approches non pharmacologiques peuvent améliorer significativement la qualité de vie des patients PSP :
Kinésithérapie : Exercices d’équilibre, renforcement musculaire, prévention des chutes. La rééducation vestibulaire peut aider à compenser partiellement les troubles de l’équilibre.
Orthophonie : Prise en charge des troubles de la déglutition pour prévenir les fausses routes, exercices pour maintenir la parole le plus longtemps possible, conseils sur les textures alimentaires adaptées.
Ergothérapie : Adaptation de l’environnement domestique pour sécuriser les déplacements, aides techniques (déambulateur, fauteuil roulant adapté), stratégies pour compenser les troubles du regard.
Nutrition : Surveillance du poids, adaptation des textures, enrichissement calorique si nécessaire, hydratation suffisante.
Soutien psychologique : Pour le patient et les aidants, car la charge émotionnelle est considérable.
Ces interventions ne ralentissent pas la maladie, mais elles améliorent concrètement le quotidien et préviennent certaines complications.
L’espoir raisonnable : Que peut-on attendre ?
Il est crucial de garder les pieds sur terre. Aucun des médicaments actuellement en essai n’a encore prouvé son efficacité chez l’humain. Les taux d’échec dans les essais cliniques de maladies neurodégénératives restent dramatiquement élevés. Même si l’un de ces traitements fonctionne, il s’agira probablement d’un ralentissement de la progression, pas d’une guérison ou d’une stabilisation complète.
Mais ralentir la progression de 20 à 30%, comme l’espère le Dr Rojas, serait déjà un progrès considérable. Cela pourrait signifier un à deux ans de vie supplémentaire avec une meilleure qualité, plus de temps passé à marcher de manière autonome, plus de temps avant la dépendance totale. Pour les patients et leurs familles, chaque mois compte.
De plus, même si les premiers médicaments testés échouent, la plateforme continuera avec de nouveaux candidats. L’infrastructure mise en place, les données collectées et l’expertise développée bénéficieront à toute la recherche sur la PSP pour les années à venir.
Le lien avec Alzheimer : Des destins croisés
Pourquoi la PSP intéresse la recherche sur Alzheimer
La PSP et Alzheimer partagent tau comme dénominateur commun, mais avec des rôles différents. Cette complémentarité en fait des laboratoires naturels l’une pour l’autre. Les thérapies anti-tau développées pour Alzheimer peuvent être testées dans la PSP où tau est le problème principal, et inversement.
Si AADvac1 ou AZP2006 fonctionnent dans la PSP, ils pourraient également être efficaces dans les stades avancés d’Alzheimer où tau joue un rôle majeur. Inversement, les vaccins anti-tau développés pour Alzheimer, comme le JNJ-2056 de Johnson & Johnson (une immunothérapie active qui induit des anticorps dirigés contre tau phosphorylée, mentionnée dans notre article sur Alzheimer), pourraient être repositionnés pour la PSP.
Cette synergie explique pourquoi de nombreux chercheurs travaillent simultanément sur les deux maladies. Adam Boxer, co-investigateur principal de la plateforme PSP, est également un expert reconnu d’Alzheimer. Cette double expertise facilite les transferts de connaissances et accélère la recherche dans les deux domaines.
Les autres tauopathies : Une famille à géométrie variable
La PSP fait partie d’un spectre plus large de tauopathies qui partagent certaines caractéristiques mais diffèrent par leur présentation clinique et leur distribution anatomique. La dégénérescence corticobasale (CBD) accumule également tau 4R et présente des symptômes moteurs asymétriques. Certaines formes de démence frontotemporale (FTD) sont également dues à tau.
Ces maladies, bien que distinctes, pourraient bénéficier des mêmes traitements. Un médicament efficace contre tau 4R dans la PSP aurait probablement une efficacité dans la CBD. Cette perspective multiplie l’impact potentiel des recherches actuelles bien au-delà de la seule PSP.
Perspectives : Que nous réserve l’avenir ?
Les années de vérité
Les prochaines années seront cruciales. Si tout se déroule comme prévu, les résultats principaux de PROSPER avec FNP-223 pourraient être connus entre 2026 et 2027, et ceux des premiers bras de la plateforme UCSF dans les années qui suivront. Ces données nous diront si nous sommes vraiment à l’aube d’une révolution thérapeutique ou si la route sera encore longue.
Même en cas d’échec des premiers candidats, la plateforme continuera avec de nouveaux médicaments. D’autres molécules sont déjà dans le pipeline, ciblant différents aspects de la pathologie tau ou des mécanismes complémentaires comme la neuroinflammation ou le dysfonctionnement mitochondrial.
Vers une médecine de précision pour la PSP
À plus long terme, l’objectif est de développer une médecine de précision pour la PSP. Tous les patients ne progressent pas à la même vitesse, ne présentent pas exactement les mêmes symptômes, et ne répondront probablement pas aux mêmes traitements. Les biomarqueurs permettront d’identifier des sous-groupes de patients et d’adapter les thérapies en conséquence.
L’imagerie avancée et les biomarqueurs fluides permettront également d’intervenir plus précocement, peut-être même avant l’apparition des symptômes chez les personnes à risque. Cette approche préventive, déjà explorée dans Alzheimer, pourrait révolutionner la prise en charge de la PSP.
L’importance de la recherche fondamentale
Au-delà des essais cliniques, la recherche fondamentale continue de progresser. De nouvelles cibles thérapeutiques sont identifiées régulièrement. L’équipe de Yale qui a découvert les sphéroïdes axonaux dans Alzheimer explore également leur rôle dans la PSP. Les mécanismes de propagation de tau d’une cellule à l’autre sont de mieux en mieux compris, ouvrant de nouvelles pistes d’intervention.
La compréhension des facteurs génétiques de susceptibilité progresse également. Si la PSP est rarement héréditaire, certaines variations génétiques augmentent le risque de développer la maladie. Identifier ces facteurs pourrait permettre de développer des stratégies préventives pour les personnes à risque.
Conclusion : L’espoir n’est plus une utopie
Pendant des décennies, les patients PSP et leurs familles ont vécu avec une sentence sans appel : pas de traitement, pas d’espoir. Cette époque touche peut-être à sa fin. Le financement record de 75 millions de dollars, la plateforme d’essais innovante, les trois médicaments prometteurs en développement, les biomarqueurs émergents, tout converge vers un moment charnière.
Bien sûr, la prudence reste de mise. La recherche sur les maladies neurodégénératives est jonchée d’échecs et de déceptions. Mais pour la première fois, la PSP bénéficie d’une attention, de moyens et d’approches à la hauteur de l’urgence. Pour la première fois, les patients ont de vraies raisons d’espérer.
Comme le souligne le Dr Adam Boxer : « Ce partenariat public-privé représente une opportunité sans précédent d’accélérer le développement de traitements pour la PSP. En réunissant des approches thérapeutiques innovantes dans un design d’essai clinique efficace, nous visons à répondre aux besoins urgents des patients et de leurs familles en moins de temps, à moindre coût, et avec moins de patients sous placebo que les essais traditionnels. »
L’année 2025 restera dans l’histoire de la PSP comme celle où tout a basculé. Celle où cette maladie orpheline est enfin sortie de l’ombre. Celle où l’espoir est redevenu raisonnable. La révolution est en marche.
Pour aller plus loin
Associations de patients :
- CurePSP (www.psp.org) : Association de référence pour la PSP, informations sur les essais cliniques
- AFTD (www.theaftd.org) : Association pour les démences frontotemporales incluant la PSP
Essais cliniques :
- ClinicalTrials.gov : Base de données des essais cliniques en cours
- Registre FTD Disorders : Pour être informé des opportunités de participation
Articles connexes :
Références
- UCSF News (September 2024). « New Hope for Progressive Supranuclear Palsy with Innovative Trial ». https://www.ucsf.edu/news/2024/09/428366/new-hope-progressive-supranuclear-palsy-innovative-trial
- AFTD (May 2025). « Two Drugs Selected for Evaluation in Platform Trial for PSP ». https://www.theaftd.org/posts/1ftd-in-the-news/blog-psp-platform-trial-update/
- Ferrer (October 2025). « We complete recruitment of 220 patients for the PROSPER study, a Phase II clinical trial in progressive supranuclear palsy (PSP) ». https://www.ferrer.com/en/Ferrer-completes-recruitment-of-220-patients-for-the-prosper-study
- Frontiers in Neurology (2025). « New progress on the role and mechanism of tau protein in progressive supranuclear palsy ». https://www.frontiersin.org/journals/neurology/articles/10.3389/fneur.2025.1551273/full
- Dunning, E.E., et al. (2024). « Pharmacotherapies for the Treatment of Progressive Supranuclear Palsy: A Narrative Review ». Neurology and Therapy. https://pmc.ncbi.nlm.nih.gov/articles/PMC11263316/
- Martinez-Valbuena, I., et al. (2024). « Four-Repeat Tau Seeding in the Skin of Patients With Progressive Supranuclear Palsy ». JAMA Neurology. https://jamanetwork.com/journals/jamaneurology/fullarticle/2824066
- CurePSP (July 2025). « A Brighter Future for Tauopathies: CurePSP’s 2025 Student Fellows Take the Lead ». https://www.psp.org/news/details/a-brighter-future-for-tauopathies-curepsps-2025-student-fellows-take-the-lead
- PRNewswire (August 2025). « Progressive Supranuclear Palsy Market on Upward Trajectory During the Forecast Period 2025-2034 with Emerging Immunotherapies ». https://www.prnewswire.com/news-releases/progressive-supranuclear-palsy-market-on-upward-trajectory
Les infographies de cet article sont la propriété intellectuelle de Okimydoc et du Dr Michel Bensadoun. Aucune utilisation n’est autorisée sans accord préalable de l’auteur.




Laisser un commentaire