Maladie à corps de Lewy (DCL) en 2026 : Progrès, espoirs et pistes pour les 5 prochaines années
La maladie à corps de Lewy (MCL), aussi appelée démence à corps de Lewy (DCL), est la deuxième démence neurodégénérative la plus fréquente après la maladie d’Alzheimer, représentant jusqu’à 24% de l’ensemble des cas de démence [1]. Longtemps sous-diagnostiquée et confondue avec les maladies d’Alzheimer ou de Parkinson en raison de leurs symptômes communs, la MCL sort de l’ombre grâce à une accélération sans précédent de la recherche. L’année 2025 a été marquée par des avancées majeures, notamment dans le domaine des biomarqueurs et des approches thérapeutiques ciblées. Cet article propose un bilan complet des progrès des cinq dernières années, un aperçu des études cliniques les plus prometteuses et une projection sur les pistes de recherche qui pourraient transformer la prise en charge de la maladie d’ici 2030.
Points clés :
- La maladie à corps de Lewy est une α-synucléinopathie, caractérisée par des symptômes cognitifs, psychiatriques, moteurs et des troubles du sommeil.
- L’année 2025 a vu l’émergence de biomarqueurs très performants, comme les tests d’amplification des graines d’α-synucléine dans le liquide céphalo-rachidien, affichant une spécificité de plus de 98% [2].
- Le Zervimesine (CT1812) a montré des résultats très encourageants en phase 2, avec une réduction de 86% des symptômes neuropsychiatriques par rapport au placebo [3].
- La recherche se concentre sur des cibles thérapeutiques comme l’agrégation de l’α-synucléine, la neuro-inflammation et les dysfonctions lysosomales.
- Les approches non pharmacologiques, telles que la kinésithérapie et l’orthophonie, restent un pilier essentiel de la prise en charge actuelle.
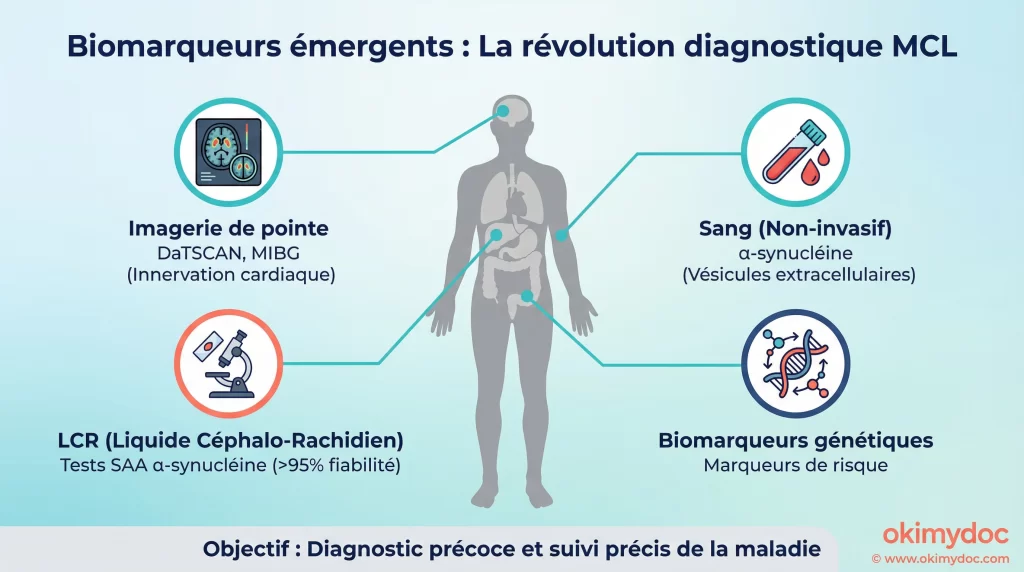
Bilan des 5 dernières années : la révolution des biomarqueurs
La période 2020-2025 a été marquée par une avancée fondamentale : la capacité à diagnostiquer la maladie à corps de Lewy avec une précision biologique inégalée. Cette percée met fin à des décennies d’errance diagnostique où la maladie était souvent identifiée tardivement, voire uniquement post-mortem.
Les succès : la détection de l’α-synucléine pathologique
Le progrès le plus significatif est la validation des tests d’amplification des graines d’α-synucléine (α-synuclein seed amplification assays, ou SAA). Réalisés sur le liquide céphalo-rachidien (LCR) prélevé par ponction lombaire, ces tests détectent la forme anormale de la protéine α-synucléine, qui est la signature de la maladie. Avec une fiabilité supérieure à 95% [2], ces tests permettent de confirmer la présence d’une pathologie à synucléine, mettant fin à des années d’incertitude diagnostique.
En deux phrases : Les tests SAA fonctionnent comme un « révélateur » biologique. Ils amplifient les infimes quantités de protéine α-synucléine anormale présentes dans le LCR, jusqu’à ce qu’elles deviennent détectables, confirmant ainsi la présence de la pathologie de Lewy.
Parallèlement, l’imagerie cérébrale a également fait des bonds de géant. Des techniques comme la scintigraphie à la MIBG (qui évalue l’innervation cardiaque sympathique, souvent affectée dans la MCL) et le DaTSCAN (qui mesure la perte de neurones dopaminergiques) sont devenues des outils de confirmation essentiels, recommandés par les consortiums d’experts [4].
Les changements de paradigme : vers un diagnostic précoce
Ces nouveaux outils ont profondément modifié la compréhension de la maladie. Alors que le diagnostic reposait sur un trépied de symptômes (fluctuations cognitives, hallucinations visuelles, parkinsonisme), il s’oriente désormais vers une définition biologique. Cette évolution permet d’identifier les patients à des stades beaucoup plus précoces, parfois même avant l’apparition de la démence, notamment chez les personnes présentant un trouble du comportement en sommeil paradoxal (TCSP), un des signes précurseurs les plus fiables de la maladie [5].
À retenir :
- Les tests SAA dans le LCR permettent un diagnostic de certitude de la pathologie de Lewy.
- L’imagerie (DaTSCAN, MIBG) confirme les atteintes neuronales spécifiques à la MCL.
- Le diagnostic devient biologique, permettant une identification plus précoce des patients.
- Le trouble du comportement en sommeil paradoxal est un marqueur de risque majeur.
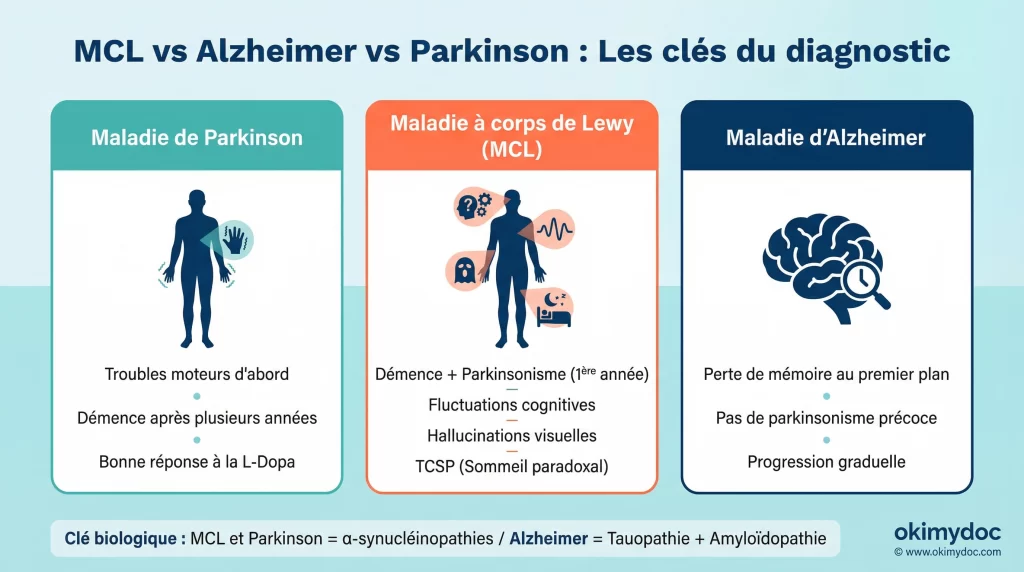
Diagnostic différentiel : ne pas confondre MCL, Alzheimer et Parkinson La confusion entre ces trois maladies est fréquente, car elles partagent des symptômes. Voici les clés pour les distinguer :
- MCL vs. Maladie de Parkinson : Dans la maladie de Parkinson, les troubles moteurs apparaissent généralement des années avant les troubles cognitifs. Dans la MCL, les troubles cognitifs et la démence apparaissent en même temps ou dans l’année qui suit les premiers symptômes moteurs (règle de la première année).
- MCL vs. Maladie d’Alzheimer : La MCL se distingue par la présence précoce et marquée de fluctuations de l’attention, d’hallucinations visuelles structurées (voir des personnages, des animaux) et de symptômes parkinsoniens. La perte de mémoire est souvent moins au premier plan au début que dans la maladie d’Alzheimer.
- La clé biologique : Alzheimer est une « tauopathie » et une « amyloïdopathie » (protéines Tau et Amyloïde). La MCL et Parkinson sont des « α-synucléinopathies ». Les nouveaux biomarqueurs permettent de faire cette distinction fondamentale.
Études en cours : les espoirs en attente de résultats
Forts de ces nouveaux outils de diagnostic, les chercheurs peuvent désormais mener des essais cliniques sur des populations de patients bien mieux définies. L’année 2025 a été riche en résultats prometteurs, faisant naître un espoir raisonnable pour des traitements modificateurs de la maladie.
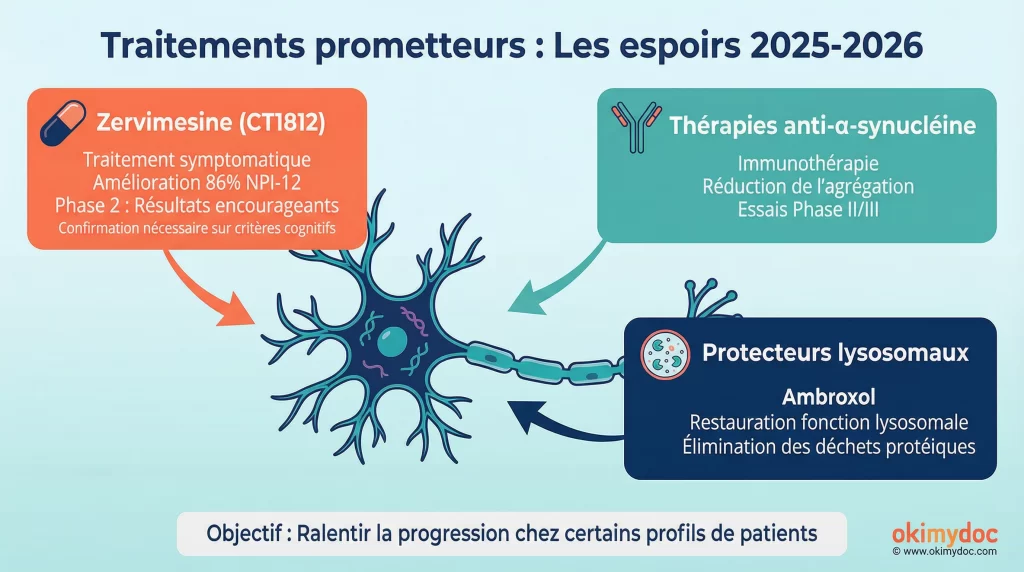
Le Zervimesine (CT1812) : un candidat très prometteur
Le Zervimesine, développé par Cognition Therapeutics, a créé l’événement lors de la conférence internationale de l’Alzheimer’s Association en juillet 2025. L’étude de phase 2 SHIMMER, menée sur 130 patients atteints de MCL légère à modérée, a atteint son critère principal de sécurité et a montré des résultats d’efficacité spectaculaires. Après six mois, le groupe traité a connu une amélioration de 86% sur l’inventaire neuropsychiatrique (NPI-12) par rapport au groupe placebo. Les symptômes les plus difficiles à traiter, comme les hallucinations, les délires et l’anxiété, ont été particulièrement améliorés [3].
Ce résultat est d’autant plus important que les médicaments antipsychotiques classiques sont souvent très mal tolérés par les patients atteints de MCL, provoquant des effets secondaires graves. Le Zervimesine se positionne donc comme une avancée majeure dans le traitement symptomatique des troubles neuropsychiatriques. Ces résultats, bien que très encourageants, devront être confirmés sur des critères cognitifs et fonctionnels à plus long terme pour déterminer si le Zervimesine a également un effet modificateur sur la progression de la maladie, ce qui n’est pas encore démontré.
Les autres approches thérapeutiques à l’étude
Au-delà du Zervimesine, plusieurs autres pistes sont activement explorées dans des essais de phase II et III. Les thérapies anti-α-synucléine visent à réduire la charge de protéine pathologique, que ce soit par immunothérapie (anticorps monoclonaux) ou en empêchant son agrégation. L’essai MASCOT de Lundbeck sur le Lu AF82422, bien que ciblant l’Atrophie Multisystématisée (une autre synucléinopathie), est suivi de près pour ses implications potentielles dans la MCL [6].
Les modulateurs de la neuro-inflammation constituent une autre piste majeure. L’inflammation chronique du cerveau joue un rôle clé dans la progression de la maladie, et des molécules visant à la réguler sont en cours d’évaluation.
Enfin, les protecteurs lysosomaux attirent beaucoup d’attention. Le lysosome, qui agit comme la « station d’épuration » de la cellule en éliminant les déchets protéiques, est souvent défaillant dans la MCL. Cette défaillance contribue à l’accumulation de l’α-synucléine. Des médicaments comme l’ambroxol (un mucolytique) sont étudiés pour leur capacité à restaurer cette fonction de nettoyage cellulaire.
Concrètement, qu’est-ce que cela change pour un patient français en 2026 ?
- Le Zervimesine n’est pas encore disponible en France, mais un programme d’accès élargi a débuté aux États-Unis en 2025, ce qui pourrait accélérer son arrivée en Europe.
- De nombreux essais cliniques recrutent activement en France. Les patients peuvent se rapprocher des centres de référence pour savoir s’ils sont éligibles.
- Le diagnostic précis grâce aux nouveaux biomarqueurs permet d’éviter les prescriptions inadaptées et dangereuses.
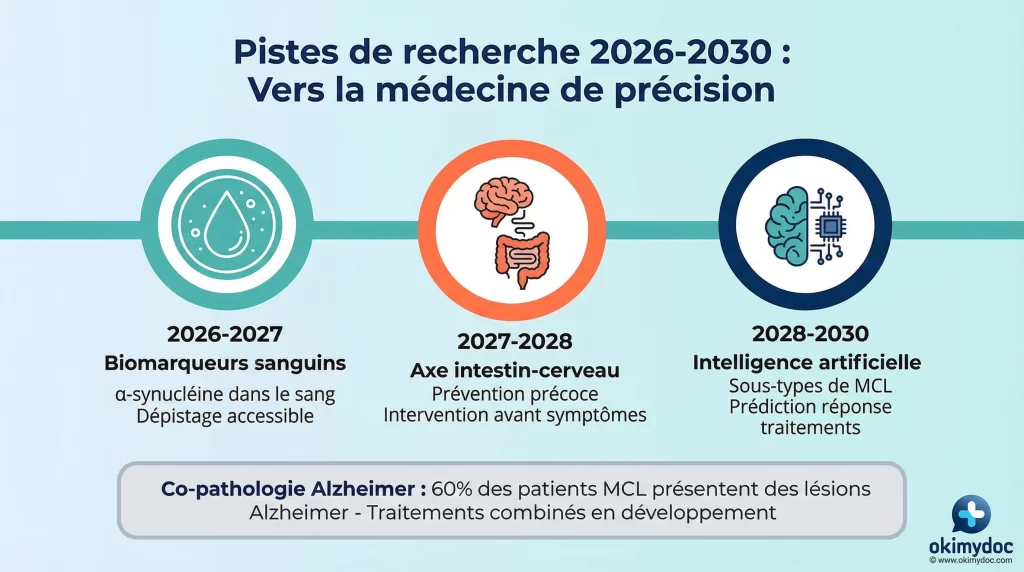
Pistes de recherche pour les 5 prochaines années
La recherche sur la MCL entre dans une nouvelle ère, celle de la médecine de précision. Les cinq prochaines années devraient voir se concrétiser les promesses nées des récentes découvertes.
Vers des biomarqueurs sanguins
Le défi majeur est de transposer la précision des biomarqueurs du LCR à une simple prise de sang. Des recherches intenses sont en cours pour isoler et analyser l’α-synucléine pathologique dans le sang, via des techniques comme l’analyse des vésicules extracellulaires. Un biomarqueur sanguin fiable, peu coûteux et accessible, transformerait radicalement le dépistage et le suivi de la maladie à grande échelle [2].
Nouvelles cibles therapeutiques
La recherche fondamentale continue de dévoiler la complexité de la maladie, ouvrant la voie a de nouvelles cibles. L’axe intestin-cerveau est l’une des pistes les plus interessantes. Des etudes suggèrent que la pathologie de l’alpha-synucleine pourrait débuter dans le système nerveux de l’intestin des annees avant d’atteindre le cerveau. Agir a ce niveau pourrait être une stratégie de prevention particulièrement prometteuse.
La co-pathologie Alzheimer est un autre enjeu majeur. Jusqu’a 60% des patients MCL présentent également des lesions de type Alzheimer (plaques amyloides et dégénérescences neurofibrillaires) [1]. Comprendre l’interaction entre ces deux pathologies est crucial pour developper des traitements combines efficaces.
Enfin, l’intelligence artificielle joue un role croissant dans la recherche. L’IA est de plus en plus utilisée pour analyser les données d’imagerie et les profils de biomarqueurs, afin d’identifier des sous-types de MCL et de prédire la réponse aux traitements. Cette approche pourrait permettre une veritable médecine de precision.
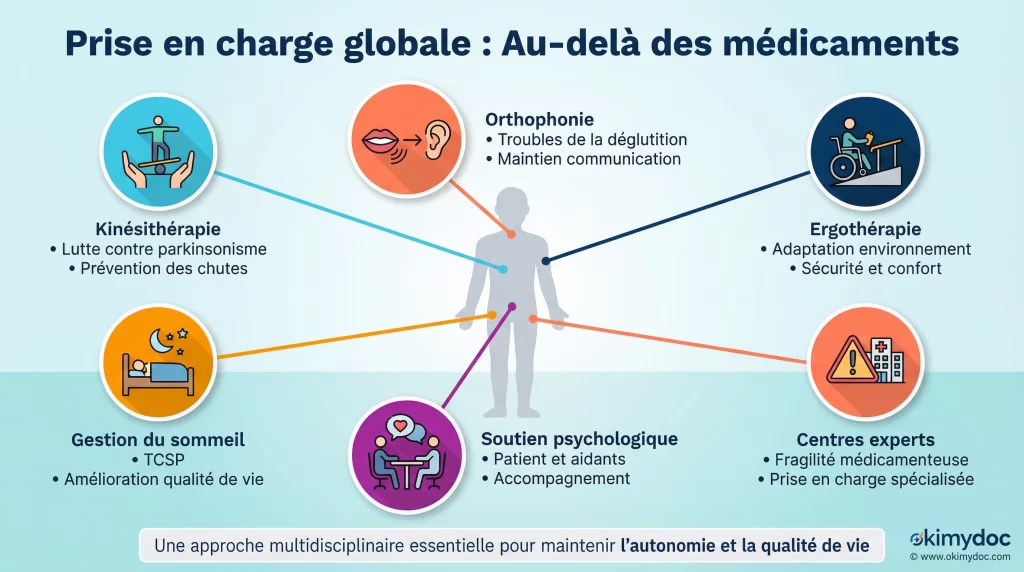
L’importance des approches non pharmacologiques
Même avec l’arrivée espérée de nouveaux médicaments, la prise en charge globale restera fondamentale. La recherche s’intéresse aussi à valider et optimiser les interventions non médicamenteuses.
Ce qui aide aujourd’hui (même sans médicament curatif) :
- Kinésithérapie : Essentielle pour lutter contre les symptômes parkinsoniens, prévenir les chutes et maintenir l’autonomie.
- Orthophonie : Cruciale pour les troubles de la déglutition (fréquents et dangereux) et pour maintenir la communication.
- Ergothérapie : Permet d’adapter l’environnement du patient pour plus de sécurité et de confort.
- Soutien psychologique : Indispensable pour le patient et pour les aidants, qui font face à une maladie particulièrement éprouvante.
- Gestion des troubles du sommeil : Une prise en charge spécifique du trouble du comportement en sommeil paradoxal peut grandement améliorer la qualité de vie.
Fragilité médicamenteuse : le rôle crucial des centres experts Les patients atteints de MCL présentent une sensibilité extrême à de nombreux médicaments, en particulier les neuroleptiques (antipsychotiques) qui peuvent provoquer des syndromes malins potentiellement mortels. Cette fragilité iatrogène impose une prudence maximale et justifie pleinement le suivi dans des centres experts. Seuls ces centres ont l’habitude de manier les traitements symptomatiques avec la précaution nécessaire et de coordonner une prise en charge multidisciplinaire complexe.
Ce que cette avancée change pour les aidants La MCL est l’une des démences les plus éprouvantes pour l’entourage, en raison des fluctuations, des troubles psychiatriques et de la charge physique liée aux troubles moteurs. Un diagnostic précoce et précis permet aux aidants de :
- Mettre des mots sur les maux : Comprendre que les hallucinations ou l’apathie sont des symptômes de la maladie et non des changements de personnalité volontaires.
- Anticiper les crises : Mieux gérer les fluctuations et les troubles du comportement.
- Accéder au bon réseau de soins : Se tourner rapidement vers les associations de patients et les centres experts.
- Bénéficier de soutien : Un diagnostic clair ouvre droit à des aides et à une reconnaissance qui sont essentielles pour tenir sur la durée.
Hétérogénéité de l’évolution et pronostic
Il est essentiel de souligner que la maladie à corps de Lewy ne suit pas une trajectoire unique. L’évolution varie considérablement d’un patient à l’autre. Certains connaîtront une progression rapide de leurs troubles cognitifs, tandis que pour d’autres, les symptômes moteurs ou psychiatriques domineront le tableau pendant des années. Cette hétérogénéité rend le pronostic difficile à établir individuellement. La présence de co-pathologies (c’est-à-dire d’autres maladies cérébrales associées, comme des lésions de type Alzheimer), peut également influencer la vitesse et la nature de la progression. Cette variabilité souligne l’importance d’un suivi personnalisé et régulier par une équipe spécialisée, capable d’adapter la prise en charge à l’évolution propre de chaque patient.
Conclusion
La maladie à corps de Lewy est à un tournant historique. Après des décennies de stagnation, la recherche a produit en l’espace de cinq ans des outils de diagnostic d’une fiabilité inespérée et des pistes thérapeutiques extrêmement prometteuses. Le Zervimesine incarne cet espoir, mais il n’est que la partie émergée d’un effort scientifique mondial intense. Les cinq prochaines années seront décisives pour transformer ces avancées en traitements concrets qui pourront ralentir, voire stopper la progression chez certains profils de patients. Cette variabilité de réponse aux traitements souligne l’importance de la médecine de précision et de l’identification de biomarqueurs prédictifs. Pour les patients et leurs familles, l’espoir n’est plus seulement permis, il est désormais fondé sur des données scientifiques solides et tangibles.
Références
[1] Sekiya H, et al. Neuropathology of Lewy body dementia: Lewy-related pathology, α-synuclein oligomers, and comorbid pathologies. Mol Neurodegener. 2025;20(1):117. https://pmc.ncbi.nlm.nih.gov/articles/PMC12581614/
[2] Zarkali A, et al. Diagnostic and other biomarkers of dementia with Lewy bodies: from research to clinical settings. Lancet Neurol. 2025;24(12):1038-1052. https://www.ucl.ac.uk/brain-sciences/news/2025/nov/advances-new-biomarkers-dementia-lewy-bodies-could-transform-diagnosis-and-care
[3] Kuntz L. New Data: Zervimesine for the Treatment of Dementia With Lewy Bodies and Alzheimer Disease. Psychiatric Times. 29 juillet 2025. https://www.psychiatrictimes.com/view/new-data-zervimesine-for-the-treatment-of-dementia-with-lewy-bodies-and-alzheimer-disease
[4] McKeith IG, et al. Diagnosis and management of dementia with Lewy bodies: Fourth consensus report of the DLB Consortium. Neurology. 2017;89(1):88-100. https://www.thelancet.com/journals/laneur/article/PIIS1474-4422(25)00363-1/fulltext
[5] Ratnavel A, et al. Risk factors and predictors for Lewy body dementia: a systematic review. npj Dementia. 2025;1:22. https://www.nature.com/articles/s44400-025-00022-2
[6] Suivre les essais cliniques dans l’AMS : Lundbeck. AMS-ARAMISE. 22 mai 2025. https://www.ams-aramise.fr/articles.php?lng=fr&pg=1776&tconfig=2
Article rédigé par le Dr Michel Bensadoun,
L’auteur ne déclare aucun conflit d’intérêts concernant cet article.
Note : Cet article a été rédigé avec l’aide de l’intelligence artificielle, notamment pour l’assistance à la rédaction et à l’illustration. Le contenu a été soigneusement relu, validé et complété par l’auteur pour garantir sa fiabilité et sa pertinence.




Laisser un commentaire