Points clés :
-
L’immunothérapie alimentaire progresse à grands pas, notamment pour l’allergie à l’arachide, avec plusieurs options thérapeutiques (orale, injectable, patch).
-
De nouveaux médicaments biologiques (remibrutinib, dupilumab) révolutionnent la prise en charge de l’urticaire chronique et de la dermatite atopique.
-
Des anticorps monoclonaux ultra-ciblés visent des allergènes spécifiques comme ceux du chat, promettant une efficacité redoutable pour la rhinite allergique.
-
Le changement climatique allonge et intensifie les saisons polliniques, forçant les allergologues à adapter leurs stratégies préventives et thérapeutiques.
-
L’intelligence artificielle s’intègre dans le diagnostic et la gestion des allergies, ouvrant la voie à une médecine véritablement personnalisée.
1. L’immunothérapie alimentaire : une désensibilisation progressive pour l’allergie à l’arachide
Après des décennies où la seule stratégie était l’éviction stricte et la gestion de l’anaphylaxie, l’immunothérapie alimentaire (ITA) a ouvert une brèche spectaculaire, en particulier pour l’allergie à l’arachide. L’enjeu pour 2026 n’est plus de savoir si l’on peut traiter, mais comment choisir la meilleure approche pour chaque patient. La Food and Drug Administration (FDA) américaine a ouvert la voie avec l’approbation de PALFORZIA®, la première immunothérapie orale (OIT) qui consiste à administrer des doses croissantes de protéine d’arachide pour désensibiliser le système immunitaire [2]. Bien qu’efficace pour augmenter le seuil de réactivité, cette approche reste contraignante et non dénuée de risques.
En deux phrases : L’immunothérapie orale (OIT) consiste à ingérer quotidiennement de petites quantités croissantes de l’allergène (comme la poudre d’arachide) sous surveillance médicale. L’objectif est d’éduquer le système immunitaire à tolérer l’allergène et à réduire le risque de réaction grave en cas d’exposition accidentelle.
Mais la véritable révolution de 2025-2026 réside dans la diversification des stratégies. L’omalizumab (Xolair®), un anticorps monoclonal anti-IgE déjà connu dans l’asthme, a reçu une approbation de la FDA en 2024 pour les allergies alimentaires multiples, y compris l’arachide. Des études montrent qu’il permet d’augmenter significativement le seuil de tolérance avec un profil de sécurité souvent jugé plus favorable que l’OIT [3]. Son biosimilaire, OMLYCLO®, a été approuvé en mars 2025, ce qui devrait améliorer son accessibilité.
Deux autres approches prometteuses devraient confirmer leur potentiel en 2026. Le Viaskin™ Peanut, un patch d’immunothérapie épicutanée (EPIT), a l’avantage d’une administration simple et d’un risque de réaction systémique très faible. Un essai chez les nourrissons est prévu pour 2026, ciblant une intervention très précoce [4]. Enfin, des approches de type vaccin, comme VLP Peanut, utilisant des particules pseudo-virales pour présenter l’allergène au système immunitaire, ont montré des résultats préliminaires encourageants fin 2025 [5].
Ce que ça change concrètement : Pour les patients allergiques à l’arachide, l’immunothérapie offre une véritable amélioration de la qualité de vie et une réduction du risque de réaction grave. Cependant, il faut bien comprendre qu’il s’agit d’une désensibilisation (augmentation du seuil de tolérance), pas d’une guérison. L’arrêt du traitement peut s’accompagner d’une réapparition des symptômes. C’est un changement majeur, mais qui demande un engagement à long terme.
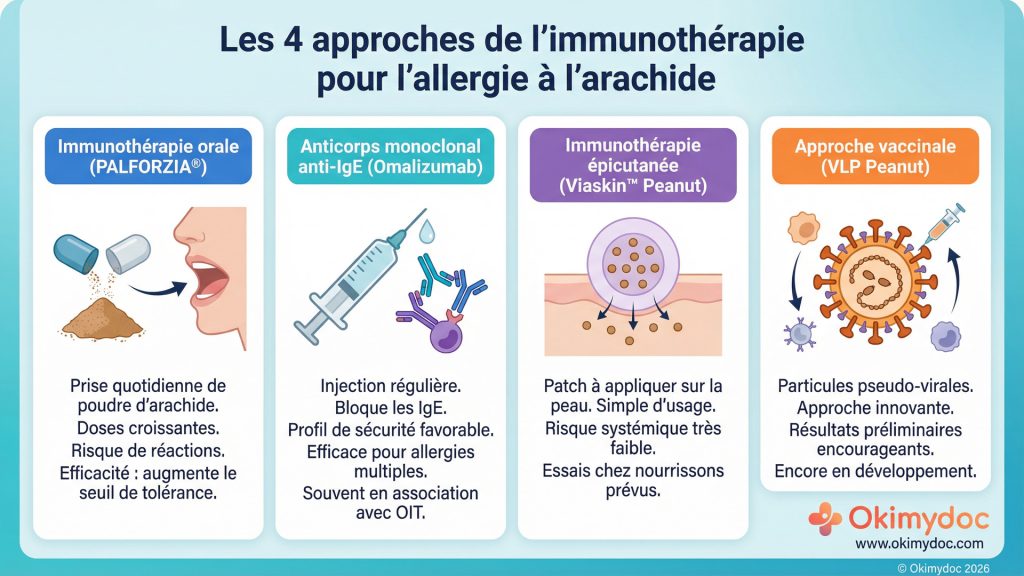
- Les 4 approches de l’immunothérapie pour l’allergie à l’arachide : orale, anticorps monoclonal, épicutanée, et vaccinale.
2. Les biologiques contre l’urticaire chronique : une révolution pour les patients
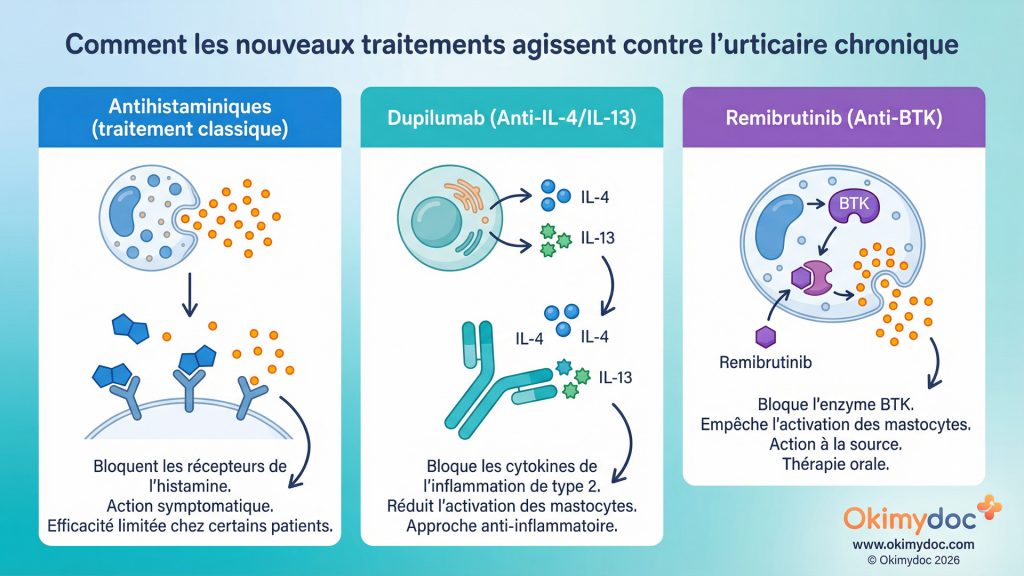
L’urticaire chronique spontanée (UCS) est une maladie débilitante caractérisée par des papules prurigineuses récurrentes, durant plus de six semaines, sans facteur déclenchant identifiable. Pour de nombreux patients, les antihistaminiques, même à haute dose, sont insuffisants. L’année 2025 a marqué un tournant majeur avec l’approbation de deux nouvelles classes de médicaments biologiques, offrant un espoir immense à ces patients en impasse thérapeutique.
En deux phrases : L’urticaire chronique spontanée est une maladie inflammatoire de la peau où les mastocytes, des cellules immunitaires, libèrent de l’histamine de manière anarchique. Cela provoque l’apparition de plaques rouges et de démangeaisons intenses, similaires à des piqûres d’ortie, de façon quasi-quotidienne.
En avril 2025, le dupilumab (Dupixent®) a été approuvé aux États-Unis comme première nouvelle thérapie ciblée en plus d’une décennie pour l’UCS [6]. Ce médicament, un anticorps monoclonal qui bloque l’interleukine 4 (IL-4) et l’interleukine 13 (IL-13), deux cytokines clés de l’inflammation de type 2, a démontré une réduction significative des démangeaisons et des lésions cutanées chez les patients non contrôlés par les antihistaminiques.
Quelques mois plus tard, en septembre 2025, une autre avancée majeure a eu lieu avec l’approbation du remibrutinib (Rhapsido®) [7]. Il s’agit d’une petite molécule administrée par voie orale, un inhibiteur de la tyrosine kinase de Bruton (BTK). La BTK est une enzyme essentielle à l’activation des mastocytes. En la bloquant, le remibrutinib empêche la libération d’histamine à la source, offrant un contrôle rapide et durable des symptômes. L’arrivée d’une thérapie orale aussi efficace est une véritable révolution pour les patients.
Ces nouvelles thérapies ciblent directement les mécanismes immunologiques de la maladie, contrairement aux antihistaminiques qui ne font que bloquer les effets de l’histamine une fois libérée. L’enjeu pour 2026 sera de positionner ces différentes molécules dans la stratégie thérapeutique : pour quels patients ? À quel moment ? En monothérapie ou en association ? Les communications des grands congrès, comme celui de l’EAACI 2025, ont largement souligné cet élan sans précédent dans le domaine [8].
Ce que ça change concrètement : Pour les patients atteints d’urticaire chronique résistante aux antihistaminiques, ces nouvelles molécules biologiques offrent une véritable amélioration du contrôle des symptômes et de la qualité de vie. Cependant, elles demandent une surveillance médicale régulière et leur accès peut être limité par les coûts et les critères de remboursement selon les pays.
3. Anticorps monoclonaux ciblés pour la rhinite allergique : des promesses à confirmer
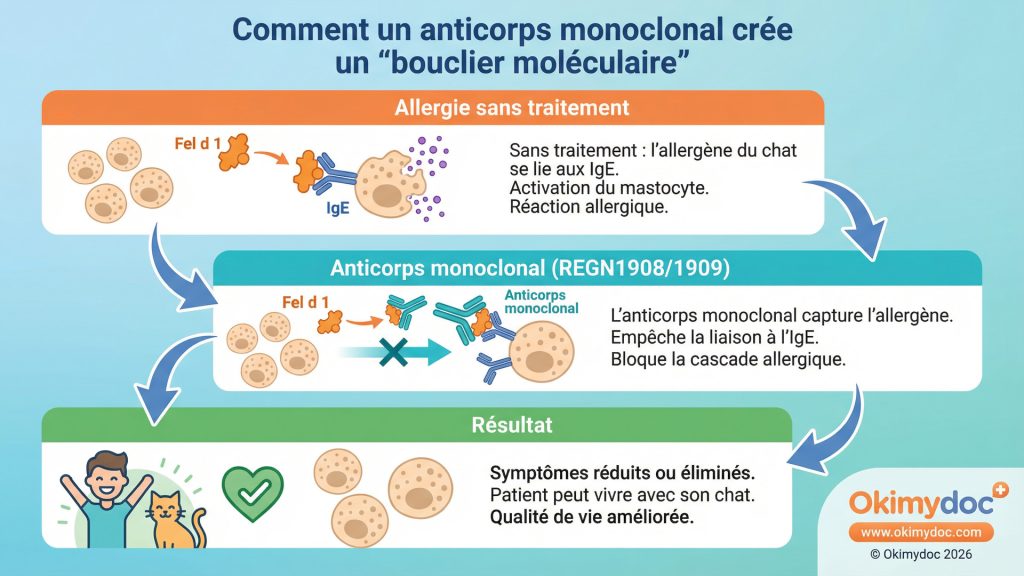
La rhinite allergique, ou « rhume des foins », a longtemps été traitée avec des approches généralistes : antihistaminiques, corticoïdes nasaux et immunothérapie allergénique (AIT) globale. Si ces traitements restent la base, l’année 2026 voit l’émergence d’une approche de rupture : les anticorps monoclonaux dirigés contre des allergènes spécifiques. Cette stratégie s’apparente à un missile guidé, neutralisant la cause de l’allergie avant même qu’elle ne déclenche une réaction.
L’avancée la plus spectaculaire vient de Regeneron, qui a annoncé en septembre 2025 des résultats de phase 3 positifs pour deux anticorps monoclonaux, REGN1908 et REGN1909 [9]. Ces molécules ciblent et bloquent spécifiquement l’allergène majeur du chat, Fel d 1. Pour les millions de personnes allergiques aux chats, cela pourrait signifier la fin des symptômes sans avoir à se séparer de leur animal. L’idée est de créer un « bouclier moléculaire » qui intercepte les allergènes avant qu’ils n’atteignent les cellules immunitaires.
En deux phrases : Les anticorps monoclonaux anti-allergènes sont des protéines thérapeutiques conçues pour reconnaître et neutraliser une molécule allergisante spécifique (ex: une protéine de chat). Administrés au patient, ils agissent comme des leurres, empêchant l’allergène de se lier aux IgE et de déclencher la cascade allergique.
Cette approche n’est pas limitée aux animaux. Des chercheurs ont développé un anticorps monoclonal (XA19) qui, administré par voie nasale, protège efficacement contre l’allergie au pollen d’ambroisie [10]. L’application locale permet une action rapide et limite les effets systémiques. De même, le stapolikibart, un autre biologique, a montré une amélioration significative des symptômes nasaux et oculaires dans la rhinite saisonnière [11].
Important à noter : Ces thérapies sont très prometteuses, mais la plupart ne disposent pas encore d’une autorisation de mise sur le marché (AMM) large dédiée à la rhinite allergique seule. Les données cliniques sont encore en cours d’évaluation, et leur place dans la stratégie thérapeutique standard reste à définir. Leur coût et leur accessibilité sont également des questions ouvertes. Ces molécules représentent une direction intéressante, mais elles demandent une confirmation dans les années à venir.
Ces thérapies de haute précision représentent un changement de paradigme potentiel. Au lieu de calmer l’inflammation (corticoïdes) ou de bloquer ses effets (antihistaminiques), elles s’attaquent à la racine du problème. L’enjeu pour 2026 et au-delà sera de développer des cocktails d’anticorps capables de cibler les principaux allergènes d’une région (bouleau, graminées, acariens) pour offrir une protection complète et personnalisée. Cela pourrait, à terme, représenter une alternative à l’immunothérapie allergénique traditionnelle, qui demande un engagement de plusieurs années.
4. Dermatite atopique : l’arsenal des biologiques s’élargit
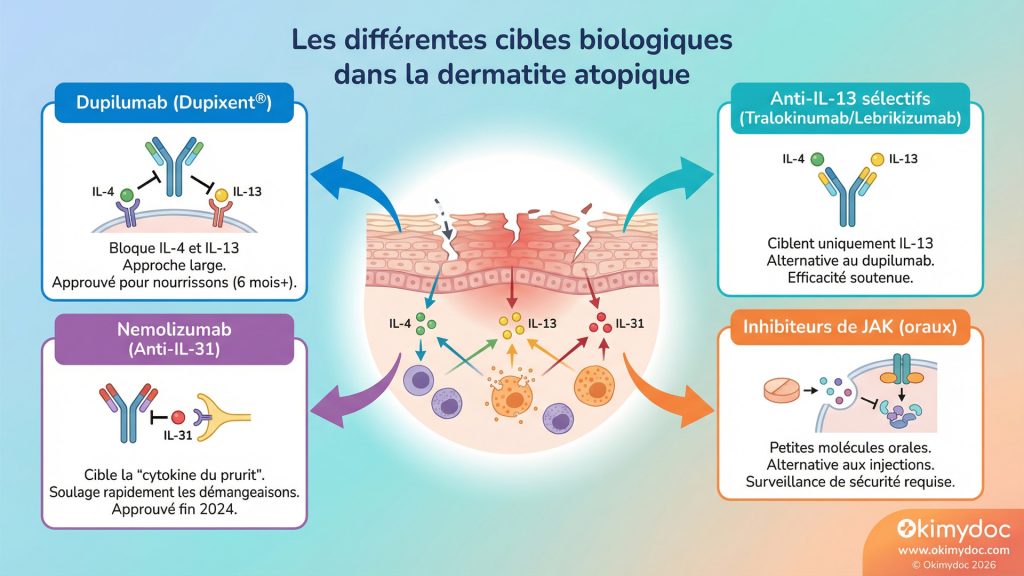
La dermatite atopique (DA), ou eczéma atopique, est bien plus qu’une simple maladie de peau. C’est une affection inflammatoire chronique, complexe, qui altère profondément la qualité de vie. L’arrivée du dupilumab en 2017 a été une première révolution. En 2026, nous assistons à une véritable explosion de l’arsenal thérapeutique, avec une compréhension de plus en plus fine des voies immunologiques impliquées et des médicaments capables de les bloquer sélectivement.
Le dupilumab (Dupixent®), qui bloque la voie de l’IL-4 et de l’IL-13, a confirmé sa place de leader en étendant son approbation aux nourrissons dès 6 mois, permettant une prise en charge très précoce de la maladie [12]. Mais il n’est plus seul. Le tralokinumab, qui cible sélectivement l’IL-13, et le lebrikizumab, qui a démontré une efficacité et une sécurité soutenues, sont venus enrichir la famille des anti-IL-13, offrant des alternatives aux patients [13].
En deux phrases : La dermatite atopique est due à une double anomalie : une barrière cutanée défectueuse qui laisse entrer les allergènes et une hyperactivité du système immunitaire (dite « de type 2 »). Les biologiques ciblent les messagers de cette hyperactivité, les interleukines (IL-4, IL-13, IL-31), pour calmer l’inflammation de l’intérieur.
L’innovation ne s’arrête pas là. Une nouvelle cible a fait son apparition : l’IL-31, souvent surnommée la « cytokine du prurit » (démangeaison). Le nemolizumab, un anticorps monoclonal anti-récepteur de l’IL-31, a été approuvé fin 2024. En bloquant spécifiquement la voie de la démangeaison, il apporte un soulagement rapide et significatif, un enjeu majeur pour les patients dont le sommeil et la vie sociale sont rythmés par le grattage.
L’enjeu pour 2026 est double. D’une part, il s’agit de la médecine de précision : quel patient bénéficiera le plus d’un blocage double (IL-4/IL-13) ou d’un blocage sélectif (IL-13 seule ou IL-31) ? Des biomarqueurs sont activement recherchés pour guider ce choix. D’autre part, de nouvelles classes thérapeutiques arrivent, notamment les inhibiteurs de JAK (Janus Kinase). Ces petites molécules orales, comme l’upadacitinib ou l’abrocitinib, offrent une alternative aux injections mais avec un profil de sécurité qui demande une surveillance plus étroite.
Ce que ça change concrètement : Pour les patients atteints de dermatite atopique modérée à sévère, la diversification des biologiques offre des options de traitement adaptées à différents profils et préférences (injection vs comprimé, fréquence d’administration). Cependant, l’accès à ces molécules reste variable selon les pays et les systèmes de santé, et le choix du traitement optimal demande une expertise médicale.
5. Le changement climatique : un défi direct pour l’allergologue
Le changement climatique n’est plus une menace lointaine, c’est une réalité clinique quotidienne dans les cabinets d’allergologie. L’augmentation des températures, la concentration élevée de CO2 dans l’atmosphère et la modification du régime des précipitations ont un impact direct et mesurable sur les allergènes, transformant la saison des allergies en un marathon de plus en plus éprouvant pour les patients.
Le premier effet, largement documenté, est l’allongement de la saison pollinique. Des études menées aux États-Unis montrent que la saison des allergies commence en moyenne 20 jours plus tôt et dure 10 jours de plus qu’en 1990 [14]. Le réchauffement permet aux plantes de démarrer leur pollinisation plus précocement au printemps et de la poursuivre plus tard en automne. Pour les patients, cela signifie une période de symptômes plus longue et une consommation accrue de médicaments.
En deux phrases : Le réchauffement climatique allonge la période de croissance des plantes, ce qui décale et prolonge la saison des pollens. De plus, l’excès de CO2 agit comme un « engrais », poussant les plantes à produire des quantités de pollen encore plus importantes.
Le deuxième effet est l’augmentation de la production de pollen. Le dioxyde de carbone (CO2) est essentiel à la photosynthèse. Des niveaux plus élevés de CO2 atmosphérique stimulent la croissance des plantes et, par conséquent, leur production de pollen. Une étude a montré que le pollen d’ambroisie (ragweed), l’un des plus allergisants, pourrait voir sa production augmenter de 60% avec le doublement de la concentration en CO2 [15]. Les patients sont donc exposés à une charge allergénique plus intense.
Enfin, le changement climatique favorise des phénomènes météorologiques extrêmes qui exacerbent les allergies. Les « orages d’asthme » en sont l’exemple le plus frappant. Lors d’un orage, les grains de pollen se gorgent d’humidité, éclatent en particules beaucoup plus fines qui peuvent pénétrer profondément dans les voies respiratoires et déclencher des crises d’asthme sévères chez les personnes sensibilisées, même celles n’ayant jamais eu d’asthme auparavant [16].
Pour l’allergologue de 2026, l’enjeu est d’intégrer cette nouvelle donne environnementale dans sa pratique. Cela implique une surveillance pollinique plus fine, des calendriers de traitement adaptés, une éducation des patients sur les risques liés à la météo, et un plaidoyer pour des politiques de santé publique qui prennent en compte l’impact sanitaire du changement climatique.

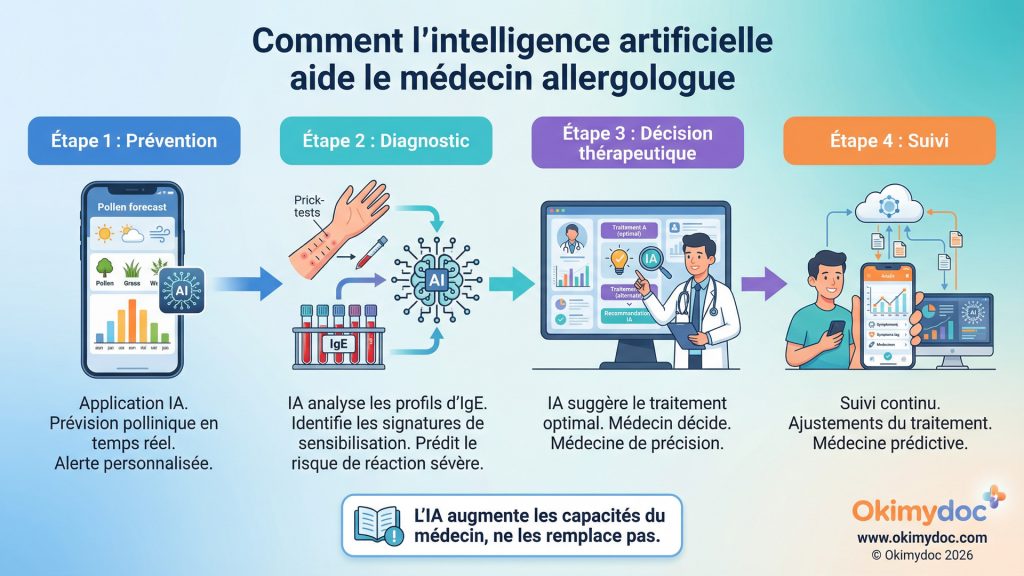
6. L’intelligence artificielle révolutionne le diagnostic allergologique
L’intelligence artificielle (IA) est en train de quitter le domaine de la science-fiction pour devenir un outil concret et puissant au service des allergologues et de leurs patients. En 2026, l’IA n’a pas pour but de remplacer le médecin, mais de l’augmenter, en lui fournissant des capacités d’analyse et de prédiction jusqu’alors inaccessibles. Son impact se fait sentir du diagnostic à la prise en charge personnalisée, en passant par la prévision des risques.
L’un des domaines les plus prometteurs est l’aide au diagnostic. L’allergologie moderne génère une quantité massive de données : résultats de tests cutanés, dosages d’IgE spécifiques pour des centaines de composants allergéniques, tests d’activation des basophiles, etc. L’IA, et en particulier l’apprentissage automatique (machine learning), excelle dans l’identification de schémas complexes (signatures de sensibilisation) au sein de ces données. Un algorithme peut, par exemple, analyser le profil d’IgE d’un patient et prédire avec une haute probabilité non seulement à quel aliment il est allergique, mais aussi le risque de réaction sévère [17].
En deux phrases : L’intelligence artificielle en allergologie utilise des algorithmes pour analyser de vastes ensembles de données (biologiques, cliniques, environnementales). Elle aide le médecin à interpréter les tests complexes, à identifier les profils de risque et à prédire l’évolution d’une maladie.
L’IA transforme également la surveillance environnementale. Des applications mobiles, couplées à des réseaux de capteurs et à des modèles météorologiques, permettent de fournir des prévisions polliniques ultra-localisées et en temps réel. Un projet comme AllergoEye utilise l’IA pour analyser des images et identifier les types de pollens, offrant une précision bien supérieure aux méthodes traditionnelles [18]. Pour le patient, cela signifie pouvoir anticiper les pics de risque et adapter ses activités ou son traitement préventif.
Enfin, l’IA ouvre la voie à une médecine véritablement personnalisée. En intégrant les données cliniques, biologiques, génétiques et environnementales d’un patient, un modèle d’IA peut aider le médecin à choisir le traitement le plus efficace. Par exemple, face à une dermatite atopique sévère, l’IA pourrait orienter le clinicien vers un anti-IL-13 plutôt qu’un anti-IL-4/IL-13 en se basant sur le profil de biomarqueurs du patient. C’est le début de la fin de l’approche « taille unique » au profit d’une stratégie sur mesure.
Important à préciser : L’IA reste un outil d’aide à la décision, pas un diagnostic autonome. Le médecin conserve un rôle central dans l’interprétation des données et la prise de décision clinique. L’IA augmente les capacités du médecin, mais ne les remplace pas.
7. Les biomarqueurs émergents : vers un diagnostic plus objectif
Le diagnostic en allergologie a longtemps reposé sur un trépied : l’histoire clinique du patient, les tests cutanés (prick-tests) et le dosage des immunoglobulines E (IgE) spécifiques. Si cette approche reste fondamentale, elle a ses limites : un test positif ne signifie pas toujours une allergie clinique pertinente, et l’évaluation de la sévérité reste subjective. L’enjeu de 2026 est l’intégration de nouveaux biomarqueurs qui apportent une information plus fonctionnelle et objective, pour un diagnostic plus fin et un meilleur suivi des traitements.
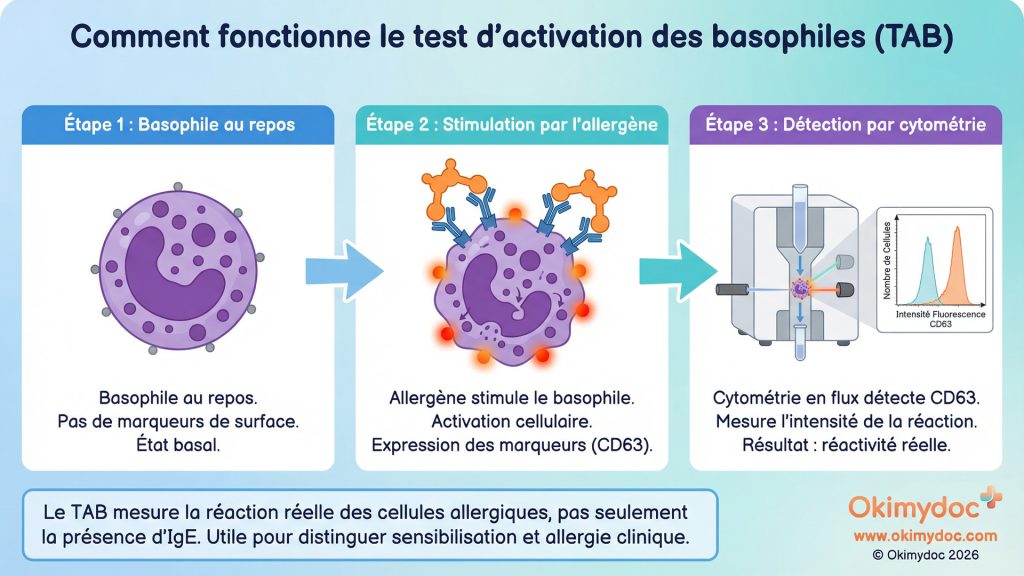
La révolution la plus attendue concerne les tests d’activation cellulaire. Au lieu de simplement mesurer la présence d’IgE (le « détonateur »), ces tests mesurent la réaction des cellules allergiques (les basophiles ou les mastocytes) lorsqu’elles sont directement mises en contact avec l’allergène. Le test d’activation des basophiles (TAB), ou Basophil Activation Test (BAT) en anglais, est le plus avancé. En mesurant l’expression de marqueurs de surface comme le CD63 après stimulation, il reflète la réactivité réelle de la cellule. Il est de plus en plus utilisé pour distinguer une simple sensibilisation d’une allergie authentique, notamment dans les allergies médicamenteuses ou alimentaires complexes [19].
En deux phrases : Un biomarqueur est un indicateur mesurable qui renseigne sur un état biologique normal ou pathologique. En allergologie, les nouveaux biomarqueurs ne se contentent plus de détecter la présence d’anticorps (IgE), mais évaluent la réaction fonctionnelle des cellules immunitaires face à un allergène.
Dans le domaine de l’immunothérapie, le suivi de l’efficacité a aussi ses nouveaux outils. Le dosage des IgG4 spécifiques de l’allergène est un biomarqueur de plus en plus reconnu. Les IgG4 sont des anticorps « bloquants » ou « protecteurs » qui entrent en compétition avec les IgE. Une augmentation de leur taux au cours d’une immunothérapie est un excellent signe que le traitement fonctionne et que le système immunitaire du patient est en train de développer une tolérance [20]. Cela permet d’objectiver la réponse au traitement bien avant de réaliser un test de provocation.
À noter : Beaucoup de ces biomarqueurs sont encore en phase de recherche ou en transition vers la pratique clinique. Leur utilisation en routine n’est pas encore généralisée en dehors des centres experts. L’enjeu pour 2026 est de valider ces outils et de les intégrer progressivement dans la pratique quotidienne, ce qui demande des études supplémentaires et une harmonisation des méthodes de mesure.
Enfin, la recherche s’oriente vers des approches encore plus intégrées, combinant plusieurs types de données. La « multi-omique » (génomique, transcriptomique, protéomique) permet d’identifier des signatures moléculaires complexes associées à différents profils d’allergie. Même si cela relève encore de la recherche, ces approches permettront à terme de prédire qui développera une allergie, qui répondra à un traitement, et qui évoluera vers la guérison. Le diagnostic de 2026 est donc moins binaire (« allergique » ou « non allergique ») et beaucoup plus nuancé, évaluant un spectre de réactivité.
8. L’allergie professionnelle : une charge largement sous-estimée
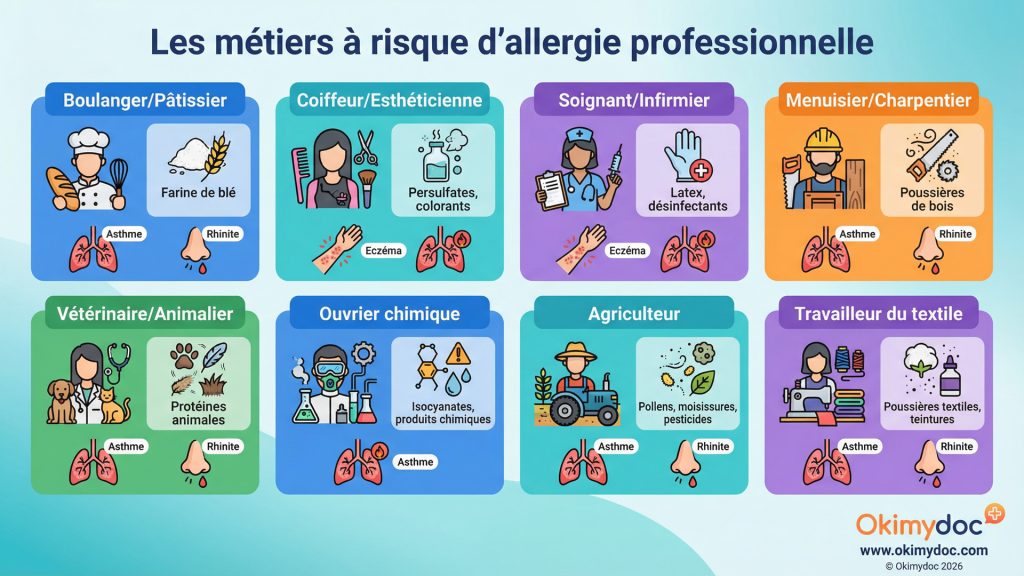
L’allergie professionnelle est le parent pauvre de l’allergologie. Souvent confondue avec des infections hivernales à répétition ou un asthme commun, elle représente pourtant une part significative des maladies respiratoires de l’adulte. L’enjeu pour 2026 est de mieux la reconnaître, la diagnostiquer et la prévenir, car elle a des conséquences socio-économiques et humaines majeures, pouvant aller jusqu’à la perte d’emploi et au handicap respiratoire.
L’asthme professionnel est la maladie respiratoire professionnelle la plus fréquente dans les pays industrialisés. On estime qu’il représente 15 à 20% de tous les cas d’asthme de l’adulte [21]. Plus de 400 substances présentes sur le lieu de travail ont été identifiées comme pouvant provoquer un asthme professionnel. On distingue deux grands types : l’asthme allergique, causé par une sensibilisation à une protéine (ex: farines de blé chez le boulanger, protéines animales chez les animaliers), et l’asthme non-allergique, déclenché par une exposition à des irritants à forte concentration (ex: chlore, ammoniac).
En deux phrases : L’allergie professionnelle est une réaction allergique (asthme, rhinite, eczéma) directement causée par une substance présente sur le lieu de travail. Les symptômes s’améliorent typiquement pendant les week-ends ou les vacances et s’aggravent lors du retour au travail.
Le principal défi est le sous-diagnostic. De nombreux patients et médecins ne font pas le lien entre les symptômes respiratoires et l’environnement de travail. Le diagnostic repose sur un interrogatoire minutieux, cherchant la chronologie des symptômes par rapport à l’exposition professionnelle. Des mesures du souffle (débit expiratoire de pointe) réalisées par le patient lui-même au travail et à la maison sont souvent nécessaires pour objectiver le lien. Des tests de provocation en milieu hospitalier peuvent être requis pour confirmer le diagnostic.
La prévention est l’autre enjeu majeur. La prévention primaire consiste à réduire l’exposition aux substances à risque à la source (ventilation, systèmes clos, substitution par des produits moins nocifs). La prévention secondaire vise à dépister précocement les travailleurs à risque pour une réorientation professionnelle avant que des lésions irréversibles ne s’installent. Malheureusement, une fois l’asthme professionnel déclaré, même l’arrêt de l’exposition ne garantit pas toujours la guérison, soulignant l’importance d’une action précoce.
En 2026, une meilleure collaboration entre allergologues, médecins du travail et employeurs est indispensable pour faire reculer ce fardeau. La reconnaissance de nouvelles allergies professionnelles (ex: aux enzymes utilisées dans les détergents ou l’industrie alimentaire) et une meilleure compréhension des mécanismes sont des domaines de recherche actifs.
9. Anaphylaxie : l’épinéphrine intranasale et le défi de l’adhérence
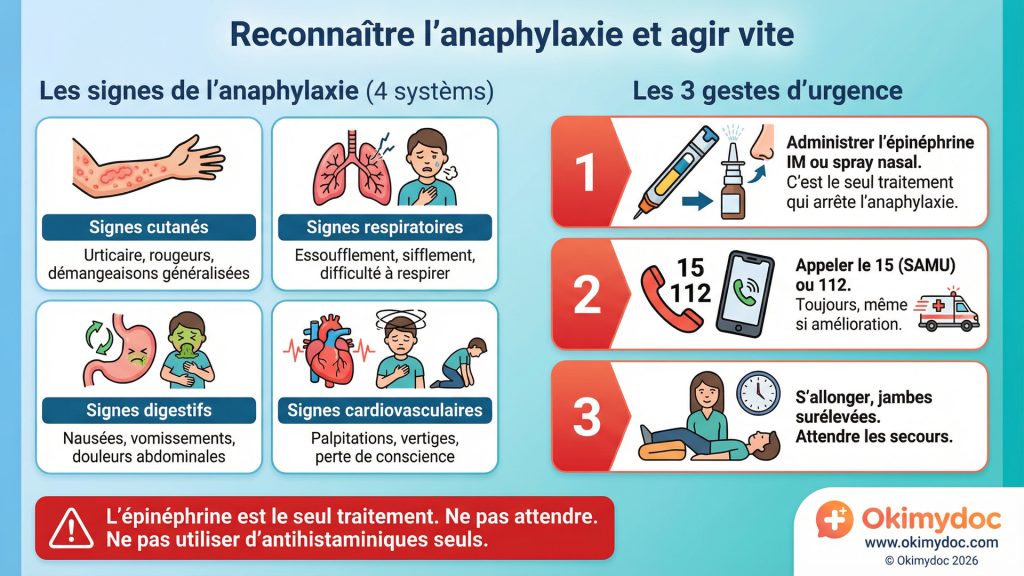
L’anaphylaxie est la manifestation la plus redoutée de l’allergie. C’est une réaction généralisée, brutale et potentiellement mortelle. Le seul traitement capable d’enrayer la cascade est l’administration rapide d’épinéphrine (adrénaline). Depuis des années, le traitement d’urgence repose sur les auto-injecteurs d’épinéphrine. Si le principe est simple, la réalité est complexe, et deux enjeux majeurs se dessinent pour 2026 : l’arrivée de nouvelles voies d’administration et la lutte contre la non-utilisation des traitements d’urgence.
Le principal problème des auto-injecteurs est la peur de l’aiguille, tant pour les patients que pour leur entourage. Cette hésitation peut entraîner un retard d’administration fatal. Pour contourner cet obstacle, une nouvelle voie d’administration est sur le point de changer la donne : l’épinéphrine intranasale. Plusieurs produits sont en phase finale de développement. Il s’agit d’un simple spray nasal, facile à utiliser, sans aiguille, et dont les études montrent une absorption rapide et une efficacité comparable à l’injection intramusculaire pour les réactions allergiques sévères [22]. Cependant, il faut noter que le débat persiste sur son utilisation dans les anaphylaxies très graves avec collapsus cardiovasculaire massif, où l’injection intramusculaire reste le gold standard. L’approbation de cette nouvelle forme galénique est l’une des avancées les plus attendues en allergologie.
En deux phrases : L’anaphylaxie est une réaction allergique sévère qui touche plusieurs organes (peau, poumons, cœur, système digestif). L’épinéphrine est le traitement d’urgence vital car elle contracte les vaisseaux sanguins (remontant la pression artérielle) et ouvre les bronches.
Cependant, une nouvelle technologie ne résoudra pas tout. Le deuxième enjeu est celui de l’adhérence et de l’éducation. De nombreuses études montrent que même lorsque les patients ont un auto-injecteur sur eux, ils ne l’utilisent pas ou l’utilisent trop tard. Les raisons sont multiples : difficulté à reconnaître les premiers signes de l’anaphylaxie, peur des effets secondaires de l’épinéphrine (qui sont bénins et transitoires), ou espoir que la réaction passe avec un simple antihistaminique (ce qui est une erreur grave).
L’éducation thérapeutique est donc plus cruciale que jamais. Les allergologues de 2026 doivent consacrer du temps à des simulations, à l’élaboration de plans d’action personnalisés et à la démystification de l’épinéphrine. Des applications mobiles connectées, des rappels automatiques pour le renouvellement des trousses d’urgence périmées, et des programmes de formation dans les écoles et les restaurants font partie des stratégies pour améliorer la préparation face à l’anaphylaxie. La meilleure des thérapies n’est utile que si elle est utilisée correctement et à temps.
10. L’allergie médicamenteuse : une classification plus claire pour un diagnostic plus sûr
L’allergie médicamenteuse est un domaine complexe et à haut risque. Les réactions peuvent aller d’une simple éruption cutanée à une anaphylaxie mortelle ou à des toxidermies graves. Pendant des années, la classification des réactions d’hypersensibilité aux médicaments était confuse. L’enjeu pour 2026 est d’adopter une approche plus rationnelle, basée sur les mécanismes immunologiques, pour améliorer le diagnostic, sécuriser la réintroduction de médicaments et éviter des évictions inutiles qui privent les patients de traitements essentiels.
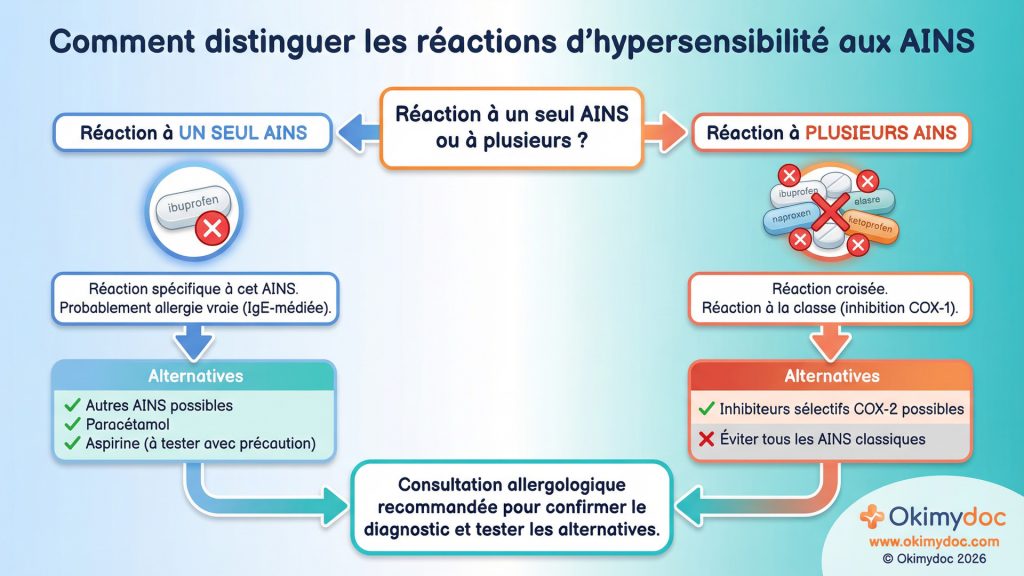
Un pas de géant a été franchi avec la nouvelle classification de l’Organisation Mondiale de l’Allergie (WAO), mise à jour en 2025, notamment pour l’hypersensibilité aux anti-inflammatoires non stéroïdiens (AINS), l’une des plus fréquentes [23]. Cette classification ne se base plus seulement sur les symptômes, mais sur le mécanisme suspecté (IgE-médié ou non), le type de réaction (immédiate ou retardée) et la réactivité croisée entre les différentes molécules d’AINS. Par exemple, on distingue maintenant clairement les patients qui réagissent à un seul AINS (réaction spécifique, probablement allergique) de ceux qui réagissent à toute la classe (réaction croisée, liée à l’inhibition de l’enzyme COX-1).
En deux phrases : L’allergie médicamenteuse est une réaction immunologique anormale à un médicament. La nouvelle classification permet de mieux comprendre si la réaction est due à une allergie vraie (IgE-médiée) ou à un autre mécanisme, ce qui guide le choix des tests et les possibilités de trouver une alternative sûre.
Cette approche plus fine a des conséquences pratiques immédiates. Pour un patient ayant réagi à l’ibuprofène, une classification précise permettra de savoir s’il peut prendre en toute sécurité un autre type d’anti-inflammatoire (comme un inhibiteur sélectif de la COX-2) ou s’il doit tous les éviter. Le diagnostic s’est lui aussi affiné. Si les tests cutanés restent utiles pour certains antibiotiques, de nouveaux outils comme le test d’activation des basophiles (TAB) ou les tests de transformation lymphocytaire (TTL) gagnent en importance pour explorer les réactions retardées [24].
L’autre grand défi est l’hypersensibilité aux médicaments biologiques. Ces protéines thérapeutiques (anticorps monoclonaux, etc.) sont de plus en plus utilisées, mais peuvent elles-mêmes induire des réactions immunitaires. Des algorithmes de diagnostic et de prise en charge ont été développés en 2024 pour gérer ces situations complexes. Ils permettent de déterminer si une réaction est une véritable allergie ou un effet secondaire, et si le traitement peut être poursuivi, éventuellement avec une prémédication ou un protocole de désensibilisation (accoutumance).
Conclusion
L’allergologie de 2026 est une spécialité en pleine effervescence, portée par une dynamique scientifique sans précédent. Les dix enjeux que nous avons explorés dessinent les contours d’une discipline qui s’éloigne de la gestion des symptômes pour s’engager résolument sur la voie de la médecine de précision. De l’immunothérapie qui modifie le cours de la maladie à l’intelligence artificielle qui personnalise le diagnostic, en passant par les thérapies biologiques qui ciblent les mécanismes moléculaires, les outils à la disposition des médecins et des patients n’ont jamais été aussi puissants.
Cependant, ces avancées technologiques s’accompagnent de nouveaux défis. L’impact grandissant du changement climatique nous rappelle que la santé humaine est indissociable de celle de notre planète. La complexité et le coût des nouveaux traitements posent la question de leur accessibilité. Enfin, la meilleure des innovations reste vaine sans l’éducation et l’adhésion du patient, comme le montre le défi persistant de l’anaphylaxie.
Pour les patients allergiques, l’espoir est plus que jamais raisonnable. Les progrès sont concrets, tangibles, et changent déjà des vies. Pour les professionnels de santé, la décennie à venir sera passionnante, exigeant une mise à jour constante des connaissances et une approche de plus en plus intégrée, où la biologie moléculaire, la science des données et les sciences environnementales dialoguent pour le bien-être du patient.
Mais il faut le rappeler : l’allergologie entre dans une ère de précision, mais reste une médecine du temps long, du suivi et de l’éducation du patient. Les meilleures molécules ne suffisent pas ; c’est la relation thérapeutique, la compréhension de la maladie par le patient et son engagement dans le traitement qui font la différence.
Sources consultées pour cet article
Cet article s’appuie sur 24 sources scientifiques récentes, incluant des publications dans des revues de référence (Journal of Allergy and Clinical Immunology: In Practice, Frontiers in Allergy, Annals of Allergy, Asthma & Immunology), des communications des congrès internationaux EAACI 2025, des communiqués de presse d’organismes officiels (FDA, Sanofi, Regeneron), et des analyses d’organismes de référence (Climate Central, Yale Climate Connections, BBC Future). Les références couvrent la période 2023-2026 pour garantir l’actualité des informations sur les avancées en allergologie.
Liste des références
[1] EAACI. Global Atlas of Allergy. 2023.
Apport : Atlas mondial de référence fournissant les données épidémiologiques sur la prévalence des allergies à l’échelle internationale.
[2] PALFORZIA®. Site officiel.
Apport :
[3] Hopkins Medicine. Newsroom. Omalizumab for Food Allergies. Mars 2025.
Apport : Étude comparative démontrant l’efficacité de l’omalizumab (anti-IgE) pour les allergies alimentaires multiples, souvent en association avec l’OIT.
[4] Allergic Living. Viaskin Peanut Patch to Go Before FDA. Novembre 2025.
Apport : Annonce de la soumission du patch Viaskin Peanut à la FDA et des essais prévus chez les nourrissons, ouvrant une nouvelle voie d’immunothérapie épicutanée.
[5] DDW Online. Immunotherapy could treat nut allergies. Décembre 2025.
Apport : Résultats préliminaires encourageants de l’approche vaccinale VLP Peanut (particules pseudo-virales) pour l’allergie à l’arachide.
[6] Sanofi. Press Release: Dupixent approved in the US. Avril 2025.
Apport : Communiqué officiel de l’approbation FDA du dupilumab (Dupixent®) pour l’urticaire chronique spontanée en avril 2025.
[7] NCBI. A new era in chronic spontaneous urticaria: FDA approval of remibrutinib. Janvier 2025.
Apport : Analyse de l’approbation FDA du remibrutinib (anti-BTK) en septembre 2024, premier inhibiteur oral ciblant l’enzyme BTK pour l’urticaire chronique.
[8] EMJ Reviews. Updates on Chronic Spontaneous Urticaria: EAACI 2025. Juillet 2025.
Apport : Synthèse des communications du congrès EAACI 2025 sur les avancées thérapeutiques dans l’urticaire chronique spontanée.
[9] Regeneron. News Release: Regeneron Advances Allergy Pipeline. Septembre 2025.
Apport : Résultats positifs de Phase III pour les anticorps monoclonaux REGN1908/1909 ciblant l’allergène Fel d 1 du chat, créant un « bouclier moléculaire ».
[10] Frontiers in. ‘Molecular shield’ placed in the nose may soon treat pollen allergies. Juillet 2025.
Apport : Explication du concept de « bouclier moléculaire » par anticorps monoclonaux pour la rhinite allergique, interceptant les allergènes avant la réaction.
[11] EMJ Reviews. Seasonal Allergy Symptoms Improved With New Biologic Treatment.
Apport : Données sur l’efficacité du stapokibart et d’autres biologiques pour la rhinite allergique saisonnière, avec réduction significative des symptômes.
[12] Annals of Allergy, Asthma & Immunology. New treatments in atopic dermatitis update. 2025.
Apport : Revue exhaustive des nouveaux traitements biologiques et inhibiteurs de JAK pour la dermatite atopique en 2025.
[13] Dermatology Times. Highlighting Major Breakthroughs for Atopic Dermatitis. 2025.
Apport : Synthèse des avancées majeures 2025 pour la dermatite atopique, incluant l’approbation du nemolizumab (anti-IL-31) fin 2024.
[14] Climate Central. 2025 Allergy Season. Mars 2025.
Apport : Analyse de l’impact du changement climatique sur l’allongement de la saison pollinique 2025, avec données chiffrées sur l’augmentation de la durée.
[15] Yale Climate Connections. Climate change is supercharging fall allergies. Septembre 2025.
Apport : Étude démontrant l’augmentation de la concentration de pollen et l’allongement des saisons allergiques automnales en raison du réchauffement climatique.
[16] BBC Future. How climate-driven thunderstorms supercharge pollen allergies. Avril 2025.
Apport : Explication du phénomène des « orages allergiques » (thunderstorm asthma) où les orages fragmentent le pollen et intensifient les réactions allergiques.
[17] JACI: In Practice. The Future of Allergy Management: How Artificial Intelligence Is Changing the Game. Septembre 2025.
Apport : Revue des applications de l’intelligence artificielle en allergologie : prévision pollinique, analyse des profils IgE, prédiction du risque de réaction sévère.
[18] ScienceDirect. The future of allergy management: how artificial intelligence is changing the game. 2025.
Apport : Analyse des outils d’IA pour le diagnostic allergologique, incluant AllergoEye et les modèles prédictifs de réactions anaphylactiques.
[19] Frontiers in Allergy. Novel and promising laboratory biomarkers for allergic disease diagnosis. 2025.
Apport : Présentation des biomarqueurs émergents pour le diagnostic allergologique, incluant les biomarqueurs plasmatiques et les tests d’activation mastocytaire.
[20] Wiley Online Library. Novel Biomarkers and Diagnostic Tools in Food Allergy. Novembre 2025.
Apport : Revue des nouveaux biomarqueurs et outils diagnostiques pour les allergies alimentaires, incluant le test d’activation des basophiles (TAB).
[21] Thorax. Occupational asthma: still an underestimated burden?. 2026.
Apport : Analyse démontrant que l’allergie professionnelle reste largement sous-estimée, avec données sur les métiers à risque et les allergènes dominants.
[22] JACI: In Practice. Intranasal epinephrine: where might it fit in guidelines for managing anaphylaxis. 2025.
Apport : Évaluation de l’épinéphrine intranasale comme alternative aux auto-injecteurs intramusculaires, avec données d’efficacité et limites pour les anaphylaxies sévères.
[23] Allergy & Immunology. Reclassification of NSAID hypersensitivity according to the WAO 2025 system. 2026.
Apport : Présentation du nouveau système de classification WAO 2025 pour l’hypersensibilité aux AINS, distinguant réactions spécifiques et croisées.
[24] ScienceDirect. An updated review of the diagnostic methods in drug hypersensitivity reactions. 2025.
Apport : Revue actualisée des méthodes diagnostiques pour l’hypersensibilité médicamenteuse, incluant les tests cutanés et les tests de provocation.
Article rédigé par le Dr Michel Bensadoun.
L’auteur ne déclare aucun conflit d’intérêts concernant cet article.
Note : Cet article a été rédigé avec l’aide de l’intelligence artificielle, notamment pour l’assistance à la rédaction et à l’illustration. Le contenu a été soigneusement relu, validé et complété par l’auteur pour garantir sa fiabilité et sa pertinence.
Important :
Article rédigé par le Dr Michel Bensadoun,
L’auteur ne déclare aucun conflit d’intérêts concernant cet article.Note : Cet article a été rédigé avec l’aide de l’intelligence artificielle, notamment pour l’assistance à la rédaction et à l’illustration. Le contenu a été soigneusement relu, validé et complété par l’auteur pour garantir sa fiabilité et sa pertinence.
Important : Cet article n’a pas vocation à remplacer une consultation médicale. Chaque situation est unique et nécessite une prise en charge individualisée.



Laisser un commentaire